Абитуриенту
Виртуальный репетитор: решение задач
Стехиометрические законы химии

Закон сохранения массы веществ. Закон постоянства состава веществ. Закон Авогадро и следствия из него. Молярный объем газа. Относительная плотность газов и определение молярной массы веществ. Химические формулы сложных веществ. Количественный состав сложного вещества. Определение молекулярных и истинных формул веществ
Примеры решения типовых задач
Задача 1. Монооксид углерода («угарный газ») — опасный загрязнитель атмосферы. Он снижает способность гемоглобина крови к переносу кислорода, вызывает болезни сердечно-сосудистой системы, снижает активность работы мозга. Из-за неполного сжигания природного топлива ежегодно на Земле образуется 500 млн. т CO. Определите, какой объем (при н.у.) займет угарный газ, образующийся на Земле по этой причине.
m(CO) = 500 млн. т = 5 . 10 14 г
В решении задачи используются уравнения, связывающие между собой количество вещества, массу и молярную массу:
а также количество газообразного вещества, его объем и молярный объем:
[ . г / ] = 4 . 10 14 л = 4 . 10 11 м 3 = 400 км 3
Ответ. 4 . 10 14 л, или 4 . 10 11 м 3 , или 400 км 3 .
Задача 2. Рассчитайте объем, который занимает (при н.у.) порция газа, необходимого для дыхания, если в этой порции содержится 2,69 . 10 22 молекул этого газа. Какой это газ?
Решение. Газ, необходимый для дыхания — это, конечно, кислород. Чтобы решить задачу, сначала запишем ее условие в формульном виде:
В решении задачи используются уравнения, связывающие между собой число частиц N(O2) в данной порции вещества n(O2) и число Авогадро NA:
а также количество, объем и молярный объем газообразного вещества (н.у.):
Ответ. Порция кислорода, в которой содержится указанное в условии число молекул, занимает при н.у. объем 1 л.
Задача 3. В процессах фотосинтеза зеленые растения усваивают из воздуха газообразный оксид углерода, относительная плотность которого по водороду составляет 22. Какова формула этого оксида углерода?
Решение. Чтобы установить формулу оксида углерода CXOY, который усваивается растениями при фотосинтезе, надо знать молярную массу этого соединения. Известные нам оксиды углерода состава CO и CO2 имеют молярные массы, равные соответственно 28 и 44 г/моль.
Запишем условие задачи в формульном виде:
Запишем уравнение, связывающее между собой молярную массу газа M(CXOY), относительную плотность его по водороду D(H2) и молярную массу водорода M(H2):
Молярная масса, равная 44 г/моль, отвечает диоксиду углерода CO2.
Ответ. Формула оксида углерода — CO2.
Задача 4. Первая стадия получения серной кислоты в промышленности, дающая наибольшее количество вредных выбросов в атмосферу — обжиг пирита, минерала, отвечающего формуле FeS2. Определите массовые доли (в процентах) железа и серы в пирите. Рассчитайте массу серы, которая содержится в 1 т пирита.
Решение. Запишем условие задачи в формульном виде:
В решении задачи используются уравнения, связывающие между собой массовую долю и молярную массу каждого из элементов, входящих в состав соединения, и молярную массу соединения в целом, а именно:
w(S) = 2M(S) / M(FeS2) = (2 . 32) : 120 = 0,533 = 53,3%, или иначе:
w(S) = 100 — w(Fe) = 100 — 46,7 = 53,3%
Для расчета массы серы в 1 т пирита тоже можно использовать два пути:
m(S) = w(S) . m(FeS2) = 0,533 . 1 т = 0,533 т = 533 кг
Ответ. w(Fe) = 46,7%; w(S) = 53,3%. Масса серы в 1 т пирита — 533 кг.
Если приведенные здесь типовые задачи стали Вам совершенно понятны, приступайте к решению дополнительных задач.
www.alhimik.ru
Стехиометрические законы решение задач
Основные понятия химии
Химия — наука о веществах, их строении, свойствах и превращениях.
Вещество — это любая совокупность атомов и молекул.
Атом — наименьшая частица элемента в химических соединениях (определение 19-го века). Современное определение: атом — это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Химический элемент — это вид атомов, характеризующийся определенным зарядом ядра.
Молекула — наименьшая частица вещества, обладающая его химическими свойствами (определение 19-го века). Современное определение: молекула — это наименьшая электронейтральная замкнутая совокупность атомов, образующих определенную структуру с помощью химических связей.
Вещества делятся на индивидуальные вещества (химические соединения), образованные молекулами или атомами одного сорта, и смеси, состоящие из нескольких индивидуальных веществ, не взаимодействующих друг с другом.
Индивидуальные вещества делятся на простые и сложные.
Простые вещества образованы атомами одного элемента 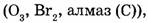 сложные вещества образованы атомами разных элементов (этанол
сложные вещества образованы атомами разных элементов (этанол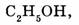 серная кислота
серная кислота 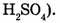
Один элемент может образовывать несколько простых веществ. Это явление называется аллотропией, а простые вещества аллотропными формами (модификациями) элемента.
Все химические элементы обозначают символами по их латинским названиям (углерод — С от слова Carboneum). Состав соединений обозначается с помощью химических формул, которые состоят из символов элементов и подстрочных индексов, указывающих число атомов данного элемента в составе молекулы. Химические формулы газообразных веществ отражают состав молекулы 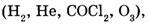 а формулы твердых и жидких веществ, как правило, описывают простейшее соотношение атомов элементов
а формулы твердых и жидких веществ, как правило, описывают простейшее соотношение атомов элементов 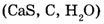 в веществе.
в веществе.
Превращения веществ, сопровождающиеся изменением их состава и (или) строения, называются химическими реакциями. При химических реакциях число атомов каждого элемента сохраняется. Химические реакции записываются посредством химических уравнений и схем. В химических уравнениях, в отличие от схем, число атомов каждого элемента одинаково в левой и правой частях, что отражает закон сохранения массы.
Коэффициенты перед формулами веществ в химических уравнениях называются стехиометрическими коэффициентами. Количества веществ, которые точно соответствуют уравнению реакции, называются стехиометрическими количествами.
Классификация химических реакций
1. По типу взаимодействия:
а) разложения 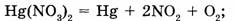
б) соединения 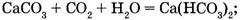
в) замещения 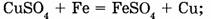
г) обмена 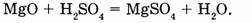
2. По изменению степеней окисления:
а) реакции, протекающие без изменения степеней окисления элементов:
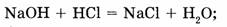
б) окислительно-восстановительные реакции, протекающие с изменением степени окисления хотя бы одного элемента:
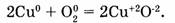
3. По знаку теплового эффекта:
а) экзотермические реакции, протекающие с выделением теплоты (+Q):
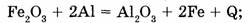
б) эндотермические реакции, протекающие с поглощением теплоты (-Q):
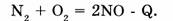
4. По направлению протекания процесса:
а) необратимые реакции, которые протекают только в одном направлении:
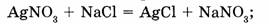
б) обратимые реакции, которые протекают
одновременно в прямом и обратном направлениях, при этом реагенты превращаются в продукты лишь частично (реакции не идут до конца):
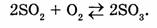
Основные законы химии
Закон сохранения массы (М. Ломоносов, 1748; А. Лавуазье, 1789): масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Периодический закон (Д. Менделеев, 1869): свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядра элемента.
Существует ряд частных законов химии, которые имеют ограниченную область применения.
Закон постоянства состава (Ж. Пруст, 1808): все индивидуальные вещества имеют постоянный качественный и количественный состав, независимо от способа их получения.
Известны соединения переменного состава, для которых закон Пруста несправедлив, например сверхпроводники общей формулы:
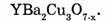
Решающую роль в доказательстве существования атомов и молекул сыграли газовые законы.
Закон объемных отношений (Ж. Гей-Люссак, 1808): объемы газов, вступающих в реакцию, а также объемы газообразных продуктов реакции, относятся друг к другу как небольшие целые числа.
Закон Авогадро — в равных объемах любых
газов при постоянных температуре и давлении содержится одинаковое число молекул.
Закон Авогадро является следствием уравнения Клапейрона — Менделеева:
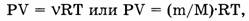 где Р — давление газа, V — его объем,
где Р — давление газа, V — его объем, 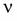 — количество газа (в молях), R — универсальная газовая постоянная, Т — абсолютная температура, m — масса газа, М — его молярная масса.
— количество газа (в молях), R — универсальная газовая постоянная, Т — абсолютная температура, m — масса газа, М — его молярная масса.
Численное значение R зависит от размерности давления (объем газов, как правило, выражают в литрах). Если [Р] = кПа, то R = 8,314 Дж/(моль*К); если [Р] = атм, то R = 0,082 л*атм/(моль*К).
Нормативные условия для газов: = 101,325 кПа = 1 атм, 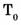 = 273,15 К = 0 °С.
= 273,15 К = 0 °С. 
При нормальных условиях объем одного моля газа равен: 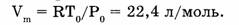
Количество газа при нормальных условиях рассчитывают по формуле:
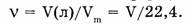
При произвольных условиях количество газа рассчитывают по уравнению Клапейрона — Менделеева:
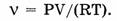
Плотность газов прямо пропорциональна их молярной массе при заданных давлении и температуре:
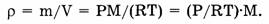
Относительная плотность газов показывает, во сколько раз один газ тяжелее другого.
Плотность газа В по газу А определяется следующим образом:
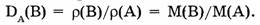
Средняя молярная масса смеси п газов равна общей массе смеси, деленной на общее число молей:
Основные понятия и законы химии. Тестовые задания.
(правильные ответы в конце раздела).
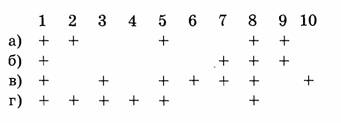
1. Отметьте правильные утверждения:
а) химический элемент обозначается химическим символом;
б) химические элементы имеют изотопы;
в) некоторые химические элементы получены искусственно;
г) в земной коре наиболее распространен элемент кислород.
2. Укажите формулы сложных веществ:
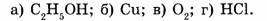
3. При каких процессах протекают химические реакции:
б) перегонка нефти;
в) гидратация этилена;
г) полимеризация этилена.
4. Укажите единицу измерения количества вещества:
а) г; б) кг; в) а.е.м.; г) моль.
5. Отметьте правильные утверждения.
Относительная атомная масса:
а) показывает, во сколько раз масса атома больше 1/12 части массы изотопа углерода 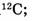
б) имеет размерность г/моль;
в) безразмерная величина;
г) приведена в Периодической системе элементов.
6. Укажите массу атома углерода:
а) 12 г; б) 6 г; в) 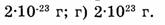
7. Отметьте правильные утверждения. Постоянная Авогадро:
а) показывает число структурных единиц в 1г вещества;
б) показывает число структурных единиц в 1 моле вещества;
в) имеет размерность 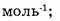
8. Укажите массы или объемы соединений, в которых содержится 1 моль вещества:
а) 22,4 л 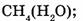
б) 98 г 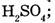
г) 26 г 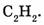
9. Укажите формулы аллотропных модификаций элемента кислорода:
б) О3;
в) 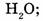
10. Укажите молекулу, которая имеет наибольшую массу:
а) 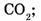 б) СО;
б) СО;
Относительная атомная и молекулярные массы. Типовые задачи и решения.
1-53. Пользуясь периодической системой химических элементов Д. И. Менделеева, укажите относительные атомные массы алюминия, хлора, натрия, кислорода, азота.
1-54, Вычислите относительную молекулярную массу карбоната кальция, имеющего формулу 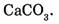
Относительные молекулярные массы кальция, углерода и кислорода соответственно равны 40, 12 и 16. Учитывая, что молекула карбоната кальция состоит из одного атома кальция, одного атома углерода и трех атомов кислорода, найдем сумму их относительных атомных масс.
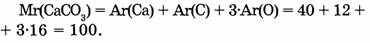
1-55. Вычислите относительную молекулярную массу сульфата алюминия, формула которого 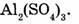
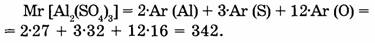
1-56. Вычислите относительную молекулярную массу ортофосфорной кислоты, если известно, что соотношение атомов водорода, фосфора и кислорода в молекуле равно соответственно 3:1:4.
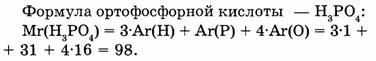
Расчеты по химическим формулам — нахождение отношения масс элементов по химической формуле в сложном веществе. Типовые задачи и решения.
1-57, Вычислите массовое отношение химических элементов в гидроксиде кальция.
1. Находим относительную молекулярную массу гидроксида кальция:
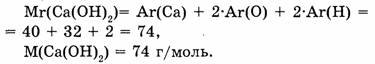
2. Находим отношение масс атомов кальция, кислорода, водорода:
Са : О : Н = 40 : 32 : 2 = 20 : 16 : 1.
Ответ. Отношение масс кальция, кислорода и водорода равно 20 : 16 : 1.
1-58. Вычислите массовое отношение химических элементов в карбонате кальция.
1. Находим относительную молекулярную массу карбоната кальция:
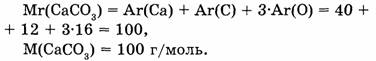
2. Находим отношение масс атомов кальция, углерода и кислорода:
Са : С : О = 40 : 12 : 48 = 10 : 3 : 12.
Ответ. Отношение масс кальция, углерода и кислорода равно 10 : 3 : 12.
Нахождение содержания массовых долей элементов в сложном веществе. Типовые задачи и решения.
1-59. Вычислите массовые доли элементов в молекуле серной кислоты.
1. Находим относительную молекулярную массу серной кислоты:
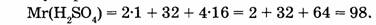
2. Вычислим массовую долю водорода:
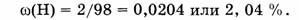
3. Вычислим массовую долю серы:
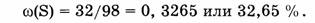
4. Вычислим массовую долю кислорода:
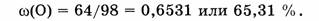
Примечание. Содержание кислорода можно также вычислить по разности:
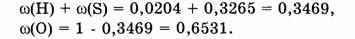
Ответ. Элементный состав 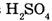 следующий:
следующий:
массовая доля Н — 2,04%, массовая доля S — 32,65 % и массовая доля О — 65,31 %.
1-60. Вычислите массовые доли элементов в молекуле оксида железа (III).
1. Находим относительную молекулярную массу оксида железа (III):
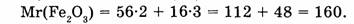
2. Вычислим массовую долю железа:
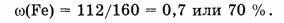
3) Вычислим массовую долю кислорода
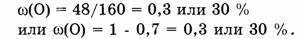
Ответ. Элементный состав 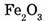 следующий:
следующий:
массовая доля Fe — 70%, массовая доля О — 30%.
Содержание и определение основных понятий, используемых при количественных расчетах в школьном курсе химии
1. Количество вещества системы — размерная величина (физическая), характеризуемая численностью содержащихся в системе структурных частиц (атомов, молекул, ионов, электронов, протонов и др.). Обозначается 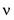 (ню) или и (эн) и может быть определено по формуле
(ню) или и (эн) и может быть определено по формуле 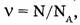 где N — число частиц в системе,
где N — число частиц в системе, 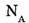 — постоянная Авогадро
— постоянная Авогадро 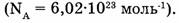
Единицей количества вещества является моль. Один моль равен количеству вещества, содержащего столько же структурных частиц данного вещества (элемента), сколько атомов содержится в углероде массой 0,012 кг 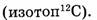
Пример. 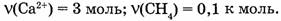
2. Молярная масса (М) — отношение массы вещества ( m ) к количеству вещества 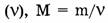 (кг/моль : г/моль).
(кг/моль : г/моль).
Пример. М(Са) = 0,04 кг/моль или М(Са) = = 40 г/моль.
3. Молярный объем 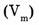 — отношение объема вещества (V) к количеству
— отношение объема вещества (V) к количеству 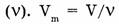
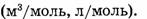
Пример. 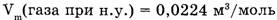 или 22,4 л/моль.
или 22,4 л/моль.
4. Массовая доля компонента в веществе (растворенного вещества в растворе, одного из компонентов в смеси, примесей в смеси). Массовой долей компонента в системе 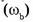 называют безразмерную физическую величину, равную отношению массы компонента
называют безразмерную физическую величину, равную отношению массы компонента 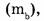 содержащегося в системе, к общей массе системы m .
содержащегося в системе, к общей массе системы m .
5. Молярная доля компонента в системе
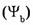 — безразмерная величина, равная отношению количества вещества компонента
— безразмерная величина, равная отношению количества вещества компонента 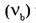 к общему количеству вещества системы
к общему количеству вещества системы 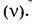
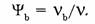
6. Молярная концентрация раствора 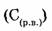 — отношение количества растворенного вещества
— отношение количества растворенного вещества 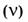 к объему раствора (V).
к объему раствора (V).
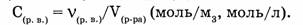
7. Объемная доля компонента в системе 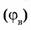 — безразмерная физическая величина, равная отношению приведенного объема компонента
— безразмерная физическая величина, равная отношению приведенного объема компонента 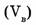 к общему объему системы (V).
к общему объему системы (V).
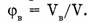
При этом естественно возникает вопрос: сколько же атомов содержится в углероде массой 12 г (в 1 моль). Как же это определить? Надо массу всех атомов углерода (12 г) разделить на массу одного атома углерода, выраженную в граммах.
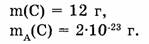
Найти. М(число атомов).
Решение: 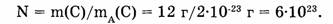
На основе решения данной задачи делают вывод: 1 моль любого вещества содержит 6*10 23 частиц (атомов, молекул и др.). Это число называют по имени итальянского ученого Амедео Авогадро. Постоянную Авогадро обозначают 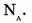
Далее можно вывести формулу для постоянной Авогадро.
Обозначим через 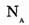 — постоянную Авогадро — число частиц в порции вещества, равной 1 моль. Тогда, как определить количество таких порций в системе
— постоянную Авогадро — число частиц в порции вещества, равной 1 моль. Тогда, как определить количество таких порций в системе 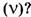
Количество вещества системы равно отношению числа частиц системы и постоянной Авогадро. Отсюда выводятся две формулы:
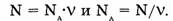
Из последней формулы следует, что постоянная Авогадро имеет размерность 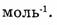
Физико-химические величины, применяемые при решении задач. Примеры решения задач.
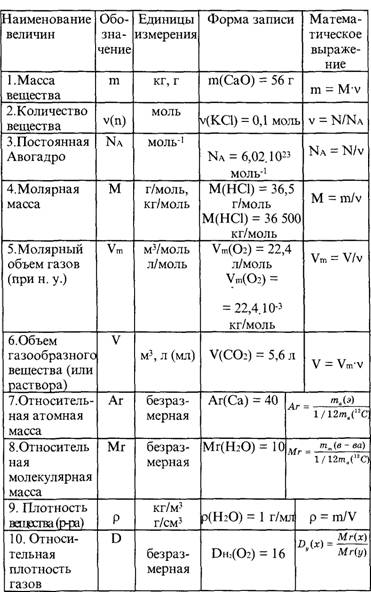

1-61. Вычислите, сколько по массе фосфора содержится в 28,4 г оксида фосфора (г).
Дано: 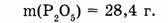
1. Находим относительную молекулярную массу оксида фосфора:
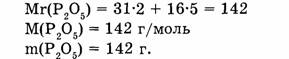
2. Вычисляем массу фосфора, содержащуюся в 28,4 г оксида фосфора:
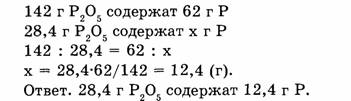
1-62. В какой массе оксида кальция содержится 1,6 г кальция?
Дано: m (Са) = 1,6 г.
1. Находим относительную молекулярную массу оксида кальция:
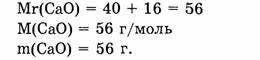
2. Вычисляем, в какой массе оксида кальция содержится 1,6 г кальция:
56 г СаО содержится 40 г Са
Х г СаО содержится 1,6 г Са
X = 56-1,6/40 = 2,24 г.
Ответ. 1,6 г содержатся в 2,24 г СаО,
1-63. Какое количество вещества составляют 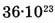 молекул азота?
молекул азота?

1-64. Сколько молекул содержится в воде массой 72 г?
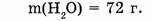
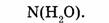
1. Определяем молярную массу воды:
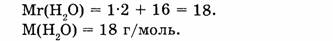
2. Находим количество вещества воды:
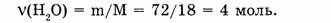
3. Определяем число молекул воды:

1-65. Какое количество вещества заключено в углекислом газе массой 110 г?
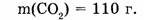
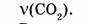
1. Определяем молярную массу углекислого газа:
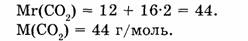
2. Находим количество вещества, заключенного в углекислом газе:
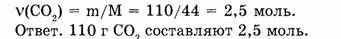
1-66. Найти массу оксида меди количеством вещества 0,4 моль.
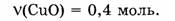
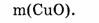
1. Определяем молярную массу оксида меди:
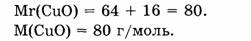
2. Находим массу оксида меди:
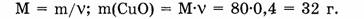
Ответ. Оксид меди количеством вещества 0,4 моль имеет массу 32 г.
1-67. Какое количество вещества составляет 23,4 сульфата натрия?
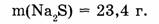
Найти: 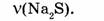
1. Находим молярную массу сульфида натрия:
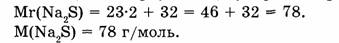
2. Находим количество вещества сульфида натрия:
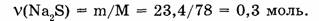
Можно рассуждать и так:
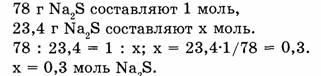
Ответ. 23,4 г сульфида натрия составляют 0,3 моль.
Расчеты, связанные с использованием плотностей, относительных плотностей и молярных объемов газов. Примеры решения задач.
Жидкости и газы взвешивать неудобно. Для этих веществ надо знать объем, поэтому необходимо вспомнить из курса физики, какая зависимость существует между массой вещества и его объемом.
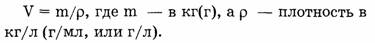
Если рассчитать объем газа количеством вещества 1 моль, тогда вместо массы вещества ( m ) следует подставить молярную массу (М) и будет получен объем, называемый молярным и обозначаемый 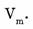
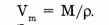
Затем, подставив вместо М и 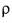 формулы, их определяющие, можно вывести формулу для определения молярного объема.
формулы, их определяющие, можно вывести формулу для определения молярного объема.
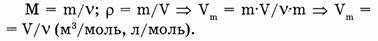
Молярный объем газа 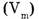 представляет собой отношение его объема к количеству вещества.
представляет собой отношение его объема к количеству вещества.
Формулы для расчетов:
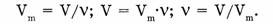
Вспомним, что кислород собирают в сосуд путем вытеснения воздуха, т.к. он немного тяжелее воздуха, а водород собирают в перевернутую вверх дном пробирку, т.к. он в 14,5 раза легче воздуха. А как это определено? Как узнать, легче или тяжелее один газ другого? Сравним эти газы по плотности.
Формула для определения плотности газов  т.е. отношение массы к объему вещества (г/л).
т.е. отношение массы к объему вещества (г/л).
Относительная плотность газов — безмерная величина, показывающая, во сколько раз плотность одного газа больше (или меньше) плотности другого 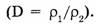 Во сколько раз масса первого газа объемом 1 л больше массы второго газа объемом 1 л, во столько раз первый газ тяжелее второго. А поскольку любой газ объемом 1 л содержит одинаковое число молекул, то, во сколько раз одна молекула первого газа тяжелее одной молекулы второго газа, такова будет относительная плотность первого газа по второму, т.е.
Во сколько раз масса первого газа объемом 1 л больше массы второго газа объемом 1 л, во столько раз первый газ тяжелее второго. А поскольку любой газ объемом 1 л содержит одинаковое число молекул, то, во сколько раз одна молекула первого газа тяжелее одной молекулы второго газа, такова будет относительная плотность первого газа по второму, т.е. 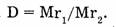
Эта же формула может быть выведена математически. Как известно:
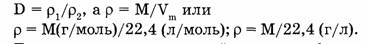
Тогда отношение плотностей двух газов будет:
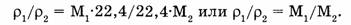
А поскольку молярная масса вещества численно равна его относительной молекулярной массе 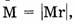 то:
то: 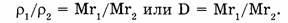
D — относительная плотность газов, внизу которой подписывают формулу газа, по отношению к которому находится плотность данного газа. 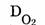 — относительная плотность по кислороду,
— относительная плотность по кислороду, 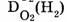 — относительная плотность водорода по кислороду, т.е
— относительная плотность водорода по кислороду, т.е 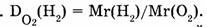
Из формулы для определения относительной плотности газов выводится формула для расчета относительной молекулярной массы неизвестного вещества.
1-79. Какой объем занимают 0,2 моль азота?
Дано: 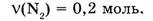
Найти: 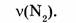
Решение. I способ.
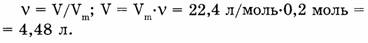
Зная, что 1 моль любого газа занимает (при н.у.) объем 22,4 л, найдем объем 0,2 азота:
1 моль азота занимает объем 22,4 л,
0,2 моль азота занимает объем х л.
Откуда: 1/22,4 = 0,2/х; х = 22,4-0,2/1 = 4,48 л.
Ответ. 0,2 моль азота занимают объем 4,48 л.
1-80. Какое количество вещества в кислороде объемом 112 л?
Дано: 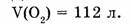
Найти: 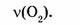
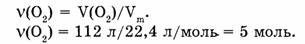
1 моль кислорода занимает объем 22,4 л, X моль кислорода занимает объем 112 л. Откуда: 1/х = 22,4/112; х = 1-112/22,4 -= 5 моль.
Ответ. Кислород объемом 112 л содержит количество вещества 5 моль.
1-81. Какова масса азота, взятого объемом 67,2 л (н.у.)?
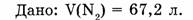
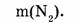
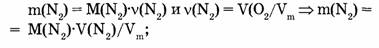
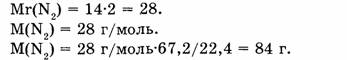
Ответ. Азот объемом 67,2 л имеет массу 84 г.
1-82. Какой объем занимают 8 г кислорода?
Дано: 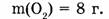
Найти: 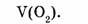
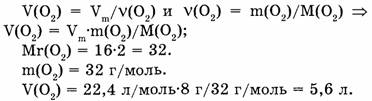
II способ. Учитывая молярный объем газа (при н.у.), составим соотношение:
32 г кислорода занимают объем 22,4 л 8 г кислорода занимают объем х л.
Откуда: 32/8 = 22,4/х; х = 8-22,4/32 = 5,6 л.
Ответ. Кислород массой 8 г занимает объем 5,6 л.
1-83. Какой объем занимают 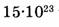 молекул водорода?
молекул водорода?
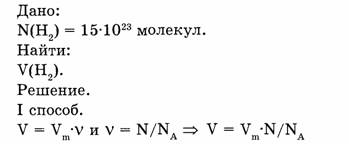

1-85. Рассчитать относительную плотность кислорода по водороду.
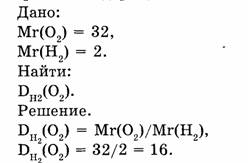
Ответ. Относительная плотность кислорода по водороду равна 16.
1-85. Плотность газа по водороду равна 8. Какова относительная молекулярная масса этого газа?
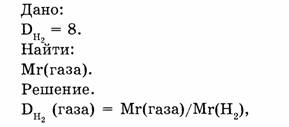
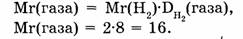
Ответ. Относительная молекулярная масса газа равна 16.
1-86. Плотность газа по воздуху равна 2. Какова масса 5,6 л (н.у.) этого газа?
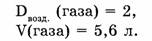
Учитывая, что средняя относительная молекулярная масса воздуха равна 29, найдем относительную молекулярную массу газа.
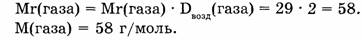
Используя следствие из закона Авогадро (1 моль газа при н.у. занимает объем 22,4 л), найдем массу 5,6 л газа.

Ответ. Газ объемом 5,6 л имеет массу 14,5 л.
Алгоритм решения задач по химическим уравнениям. Примеры решения задач.
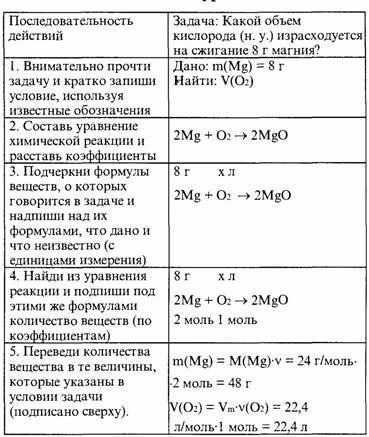

1-105. Для восстановления меди из оксида меди (II) израсходован водород объемом 1,12 л (н.у.). Сколько меди (в г) при этом выделилось?
Дано: 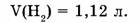
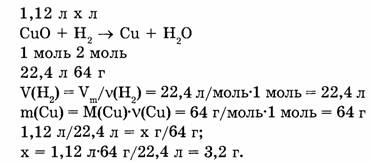
Ответ. 3,2 г меди выделилось.
1-106. Какова масса нитрата меди, образующегося при взаимодействии оксида меди (II) с азотной кислотой?
Найти: 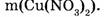

Ответ. Образуется 9,4 г нитрата меди.
1-107. Определите объем водорода, вступающего в реакцию с 15 л кислорода при образовании воды. Объемы газов измерены при н.у.

В случае газообразных веществ стехиометрические коэффициенты показывают, в каких объемных отношениях находятся участвующие в реакции и образующиеся в результате реакции вещества при одинаковых условиях. Можно сформулировать следующее правило: объемы участвующих в реакции и образующихся в результате реакции газов относятся друг к другу как соответствующие коэффициенты в уравнении реакции, т.е.:
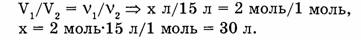
Ответ. 30 л водорода вступает в реакцию.
1-108. Вычислить объем оксида углерода (IV), полученный при сгорании ацетилена объемом 10 л (н.у.).
Дано: 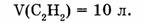
Найти: 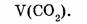
По закону объемных отношений газов при химических реакциях объемы реагирующих и получающихся газов относятся друг к другу как их коэффициенты в уравнении реакции, т.е.:
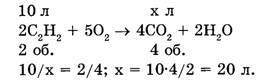
Ответ. При сжигании ацетилена объемом 10 л получится оксид углерода (IV) объемом 20 л.
Вычисления по термохимическим уравнениям. Типовые задачи и решения.
Пример 1. При сжигании серы массой 1 г выделилось 9,28 кДж теплоты. Составить термохимическое уравнение реакции.
Дано : m(S) = 1 г ., Q = 9,28 кДж .
Найти: термохимическое уравнение.
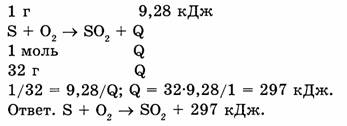
Пример 2. Какое количество теплоты выделится при сгорании метана объемом 5,6 л (н.у.), если тепловой эффект реакции 892 кДж?
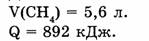
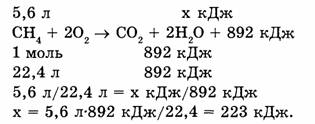
Ответ. При сгорании метана объемом 5,6 л выделится 223 кДж теплоты.
chem-solution.narod.ru
