Идеальные газы. Законы идеального газа. Уравнение Менделеева — Клапейрона.
1. Идеальным газом называется газ, в котором отсутствуют силы межмолекулярного взаимодействия. С достаточной степенью точности газы можно считать идеальными в тех случаях, когда рассматриваются их состояния, далекие от областей фазовых превращений.
2. Для идеальных газов справедливы следующие законы:
а) Закон Бойля — Mаpuomma: при неизменных температуре и массе произведение численных значений давления и объема газа постоянно:
pV = const
Графически этот закон в координатах РV изображается линией, называемой изотермой (рис.1).
б) Закон Гей-Люссака: при постоянном давлении объем данной массы газа прямо пропорционален его абсолютной температуре:
V = V0(1 + at)
где V — объем газа при температуре t, °С; V0 – его объем при 0°С. Величина a называется температурным коэффициентом объемного расширения. Для всех газов a = (1/273°С–1). Следовательно,
V = V0(1 +(1/273)t)
Графически зависимость объема от температуры изображается прямой линией – изобарой (рис. 2). При очень низких температурах (близких к –273°С) закон Гей-Люссака не выполняется, поэтому сплошная линия на графике заменена пунктиром.
в) Закон Шарля: при постоянном объеме давление данной массы газа прямо пропорционально его абсолютной температуре:
p = p0(1+gt)
где р0 — давление газа при температуре t = 273,15 К.
Величина g называется температурным коэффициентом давления. Ее значение не зависит от природы газа; для всех газов = 1/273 °С–1. Таким образом,
p = p0(1 +(1/273)t)
Графическая зависимость давления от температуры изображается прямой линией – изохорой (Рис. 3).
г) Закон Авогадро: при одинаковых давлениях и одинаковых температурах и равных объемах различных идеальных газов содержится одинаковое число молекул; или, что то же самое: при одинаковых давлениях и одинаковых температурах грамм-молекулы различных идеальных газов занимают одинаковые объемы.
Так, например, при нормальных условиях (t = 0°C и p = 1 атм = 760 мм рт. ст.) грамм-молекулы всех идеальных газов занимают объем Vm = 22,414 л.· Число молекул, находящихся в 1 см3 идеального газа при нормальных условиях, называется числом Лошмидта; оно равно 2,687*1019> 1/см3
3. Уравнение состояния идеального газа имеет вид:
pVm = RT
где р, Vm и Т — давление, молярный объем и абсолютная температура газа, а R — универсальная газовая постоянная, численно равная работе, совершаемой 1 молем идеального газа при изобарном нагревании на один градус:
R = 8.31*103 Дж/(кмоль*град)
Для произвольной массы M газа объем составит V = (M/m)*Vm и уравнение состояния имеет вид:
pV = (M/m) RT
Это уравнение называется уравнением Менделеева — Клапейрона.
4. Из уравнения Менделеева — Клапейрона следует, чти число n0 молекул, содержащихся в единице объема идеального газа, равно
n0 = NA/Vm = p*NA /(R*T) = p/(kT)
где k = R/NA = 1/38*1023 Дж/град — постоянная Больцмана, NA — число Авогадро.
www.examen.ru
Объединение учителей Санкт-Петербурга
Основные ссылки
Уравнение состояния идеального газа. Газовые законы.
Уравнение состояния идеального газа
(уравнение Менделеева – Клапейрона).
Уравнением состояния называется уравнение, связывающее параметры физической системы и однозначно определяющее ее состояние.
В 1834 г. французский физик Б. Клапейрон, работавший дли тельное время в Петербурге, вывел уравнение состояния идеального газа для постоянной массы газа. В 1874 г. Д. И. Менделеев вывел уравнение для произвольного числа молекул.
В МКТ и термодинамике идеального газа макроскопическими параметрами являются: p, V, T, m.
Мы знаем, что 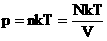 . Следовательно,
. Следовательно, 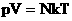 . Учитывая, что
. Учитывая, что 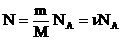 , получим:
, получим: 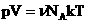 .
.
Произведение постоянных величин есть величина постоянная, следовательно: 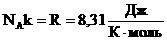 — универсальная газовая постоянная (универсальная, т.к. для всех газов одинаковая).
— универсальная газовая постоянная (универсальная, т.к. для всех газов одинаковая).
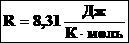
Таким образом, имеем:
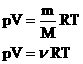 — уравнение состояния (уравнение Менделеева – Клапейрона).
— уравнение состояния (уравнение Менделеева – Клапейрона).

Другие формы записи уравнения состояния идеального газа.
1.Уравнение для 1 моля вещества.
Если n=1 моль, то, обозначив объем одного моля Vм, получим: 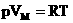 .
.
Для нормальных условий получим: 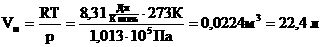

2. Запись уравнения через плотность: 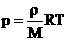 — плотность зависит от температуры и давления!
— плотность зависит от температуры и давления!
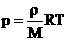
3. Уравнение Клапейрона.
Часто необходимо исследовать ситуацию, когда меняется состояние газа при его неизменном количестве (m=const) и в отсутствие химических реакций (M=const). Это означает, что количество вещества n=const. Тогда: 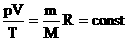
Эта запись означает, что для данной массы данного газа справедливо равенство: 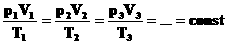
Для постоянной массы идеального газа отношение произведения давления на объем к абсолютной температуре в данном состоянии есть величина постоянная: 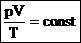 .
.
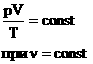
Газовые законы.
1. Закон Авогадро.
В равных объемах различных газов при одинаковых внешних условиях находится одинаковое число молекул (атомов).
Доказательство: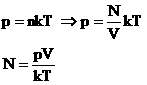
Следовательно, при одинаковых условиях (давление, объем, температура) число молекул не зависит от природы газа и одинаково.
2. Закон Дальтона.
Давление смеси газов равно сумме парциальных (частных) давлений каждого газа.
Доказательство: 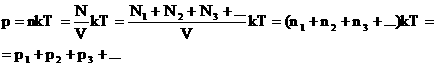
3. Закон Паскаля.
Давление, производимое на жидкость или газ, передается во все стороны без изменения.
www.eduspb.com
Законы идеального газа
Конспект лекции с демонстрациями
Аннотация: традиционное изложение темы, дополненное демонстрацией на компьютерной модели.
Из трех агрегатных состояний вещества наиболее простым является газообразное состояние. В газах силы, действующие между молекулами, малы и при определенных условиях ими можно пренебречь.
Газ называется идеальным, если:
— можно пренебречь размерами молекул, т.е. можно считать молекулы материальными точками;
— можно пренебречь силами взаимодействия между молекулами (потенциальная энергия взаимодействия молекул много меньше их кинетической энергии);
— удары молекул друг с другом и со стенками сосуда можно считать абсолютно упругими.
Реальные газы близки по свойствам к идеальному при:
— условиях, близких к нормальным условиям (t = 0 0 C, p = 1.03·10 5 Па);
— при высоких температурах.
Законы, которым подчиняется поведение идеальных газов, были открыты опытным путем достаточно давно. Так, закон Бойля — Мариотта установлен еще в 17 веке. Дадим формулировки этих законов.
Закон Бойля — Мариотта. Пусть газ находится в условиях, когда его температура поддерживается постоянной (такие условия называются изотермическими).Тогда для данной массы газа произведение давления на объем есть величина постоянная:

Эту формулу называют уравнением изотермы. Графически зависимость p от V для различных температур изображена на рисунке.

Свойство тела изменять давление при изменении объема называется сжимаемостью. Если изменение объема происходит при T=const, то сжимаемость характеризуется изотермическим коэффициентом сжимаемости  который определяется как относительное изменение объема, вызывающее изменение давления на единицу.
который определяется как относительное изменение объема, вызывающее изменение давления на единицу.

Для идеального газа легко вычислить его значение. Из уравнения изотермы получаем:


Знак минус указывает на то, что при увеличении объема давление уменьшается. Т.о., изотермический коэффициент сжимаемости идеального газа равен обратной величине его давления. С ростом давления он уменьшается, т.к. чем больше давление, тем меньше у газа возможностей для дальнейшего сжатия.
Закон Гей — Люссака. Пусть газ находится в условиях, когда постоянным поддерживается его давление (такие условия называются изобарическими). Их можно осуществить, если поместить газ в цилиндр, закрытый подвижным поршнем. Тогда изменение температуры газа приведет к перемещению поршня и изменению объема. Давление же газа останется постоянным. При этом для данной массы газа его объем будет пропорционален температуре:

где V0 — объем при температуре t = 0 0 C,  — коэффициент объемного расширения газов. Его можно представить в виде, аналогичном коэффициенту сжимаемости:
— коэффициент объемного расширения газов. Его можно представить в виде, аналогичном коэффициенту сжимаемости:

Графически зависимость V от T для различных давлений изображена на рисунке.

Перейдя от температуры в шкале Цельсия к абсолютной температуре  , закон Гей — Люссака можно записать в виде:
, закон Гей — Люссака можно записать в виде:

Закон Шарля. Если газ находится в условиях, когда постоянным остается его объем (изохорические условия), то для данной массы газа давление будет пропорционально температуре:

где р0 — давление при температуре t = 0 0 C,  — коэффициент давления. Он показывает относительное увеличение давления газа при нагревании его на 1 0 :
— коэффициент давления. Он показывает относительное увеличение давления газа при нагревании его на 1 0 :

Закон Шарля также можно записать в виде:

Закон Авогадро: один моль любого идеального газа при одинаковых температуре и давлении занимает одинаковый объем. При нормальных условиях (t = 0 0 C, p = 1.03·10 5 Па) этот объем равен  м -3 /моль.
м -3 /моль.
Число частиц, содержащихся в 1 моле различных веществ, наз. постоянная Авогадро:

Легко вычислить и число n0 частиц в 1 м 3 при нормальных условиях:

Это число называется числом Лошмидта.
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов, т.е.

где  — парциальные давления — давления, которые бы оказывали компоненты смеси, если бы каждый из них занимал объем, равный объему смеси при той же температуре.
— парциальные давления — давления, которые бы оказывали компоненты смеси, если бы каждый из них занимал объем, равный объему смеси при той же температуре.
Уравнение Клапейрона — Менделеева. Из законов идеального газа можно получить уравнение состояния, связывающее Т, р и V идеального газа в состоянии равновесия. Это уравнение впервые было получено французским физиком и инженером Б. Клапейроном и российским учеными Д.И. Менделеевым, поэтому носит их имя.
Пусть некоторая масса газа занимает объем V1, имеет давление p1 и находится при температуре Т1. Эта же масса газа в другом состоянии характеризуется параметрами V2, p2, Т2 (см. рисунок). Переход из состояния 1 в состояние 2 осуществляется в виде двух процессов: изотермического (1 — 1′) и изохорического (1′ — 2).

Для данных процессов можно записать законы Бойля — Мариотта и Гей — Люссака:


Исключив из уравнений p1 ‘ , получим

Так как состояния 1 и 2 были выбраны произвольно, то последнее уравнение можно записать в виде:

Это уравнение называется уравнением Клапейрона, в котором В — постоянная, различная для различных масс газов.
Менделеев объединил уравнение Клапейрона с законом Авогадро. Согласно закону Авогадро, 1 моль любого идеального газа при одинаковых p и T занимает один и тот же объем Vm, поэтому постоянная В будет одинаковой для всех газов. Эта общая для всех газов постоянная обозначается R и называется универсальной газовой постоянной. Тогда

Это уравнение и является уравнением состояния идеального газа, которое также носит название уравнение Клапейрона — Менделеева.
Числовое значение универсальной газовой постоянной можно определить, подставив в уравнение Клапейрона — Менделеева значения p, T и Vm при нормальных условиях:

Уравнение Клапейрона — Менделеева можно записать для любой массы газа. Для этого вспомним, что объем газа массы m связан с объемом одного моля формулой V=(m/M)Vm, где М — молярная масса газа. Тогда уравнение Клапейрона — Менделеева для газа массой m будет иметь вид:

где  — число молей.
— число молей.
Часто уравнение состояния идеального газа записывают через постоянную Больцмана:

Исходя из этого, уравнение состояния можно представить как

где  — концентрация молекул. Из последнего уравнения видно, что давление идеального газа прямо пропорционально его температуре и концентрации молекул.
— концентрация молекул. Из последнего уравнения видно, что давление идеального газа прямо пропорционально его температуре и концентрации молекул.
Небольшая демонстрация законов идеального газа. После нажатие кнопки «Начнем» Вы увидите комментарии ведущего к происходящему на экране (черный цвет) и описание действий компьютера после нажатия Вами кнопки «Далее» (коричневый цвет). Когда компьютер «занят» (т.е. идет опыт) эта кнопка не активна. Переходите к следующему кадру, лишь осмыслив результат, полученный в текущем опыте. (Если Ваше восприятие не совпадает с комментариями ведущего, напишите!)
Вы можете убедиться в справедливости законов идеального газа на имеющейся компьютерной модели самостоятельными измерениями.
teachmen.ru
Газовые законы. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона, уравнение Клапейрона) — презентация
Презентация была опубликована 3 года назад пользователемТаисия Литвинова
Похожие презентации
Презентация на тему: » Газовые законы. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона, уравнение Клапейрона)» — Транскрипт:
2 Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона, уравнение Клапейрона)
3 Газовые законы- Количественные зависимости между двумя параметрами газа при фиксированном значении третьего
4 Изотермический процесс T=const Закон Бойля – Мариотта. Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется. В термостате pV = const p, V обратная пропорциональность
5 Изотермы Изотермическое расширение T = const p V V, p 1 2 T
6 Изотермы Изотермическое сжатие T = const p V V, p 2 1 T
8 Изобарный процесс p=const Закон Гей – Люссака. Для газа данной массы отношение объема газа к температуре постоянно, если давление газа не меняется. В цилиндре с подвижным поршнем V, T прямая пропорциональность
9 Изобары Изобарное расширение (нагревание) p = const p V V, T 12 T
10 Изобары Изобарное сжатие (охлаждение) p = const p V V, T 2 1 T
12 Изохорный процесс V=const Закон Шарля. Для газа данной массы отношение давления газа к температуре постоянно, если объем не меняется. В закрытом сосуде p, T прямая пропорциональность
13 Изохоры Изохорное нагревание V = const p V p, T 1 2 T
14 Изохоры Изохорное охлаждение V = const p V p, T 2 1 T
16 Закон Дальтона Если идеальный газ является смесью нескольких газов, то согласно закону Дальтона, давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов. ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ – это такое давление, которое производил бы газ, если бы один занимал весь объем, равный объему смеси.
www.myshared.ru
Идеальный газ. Уравнение состояния идеального газа.Газовые законы;
Состояние данной массы газа полностью определено, если известны его давление, температура и объем. Эти величины называют параметрами состояния газа. Уравнение, связывающее параметры состояния, называют уравнением состояния.
Для произвольной массы газа состояние газа описывается уравнением Менделеева—Клапейрона: pV = mRT/M, где р — давление, V — объем, m — масса, М — молярная масса, R — универсальная газовая постоянная. R = 8,31 Дж/моль • К.
Газовые законы– количественные зависимости между двумя параметрами, при фиксированном значении третьего параметра.
Процесс- это переход газа из одного состояния в другое.
Изопроцесс– процесс, в котором изменяются два параметра при неизменном третьем.
1. Изобарный процесс – процесс изменения состояния термодинамической системы протекающий при постоянном давлении(р=const) .Для него справедливо соотношение, вытекающее из уравнения состояния идеального газа. . 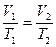 или уравнение
или уравнение 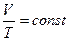 ,которое называется законом Гей-Люссака.
,которое называется законом Гей-Люссака.

2. . Изохорный процесс – процесс изменения состояния термодинамической системы , протекающий при постоянном объеме(V=const).
3..Изотермический процесс— процесс, протекающий в системе с неизменной массой при постоянной температуре(T=const). Он описывается законом Бойля—Мариотта: РV =const
studopedia.su
