Оглавление:
Правила определения степени окисления химических элементов
Степень окисления (С.О.) – условный заряд атома в соединении, который определяется исходя из предположения, что все связи в соединении ионные.
С.О. элемента = заряду иона
Na +1 Cl -1 ; Mg + 2 F -1 2
Соединение с ковалентной неполярной связью:
С.О. элемента в простом веществе = нулю
Запомнить: F 0 2; Cl 0 2; Br 0 2; I 0 2; N 0 2; O 0 2; H 0 2
С.О. = № группы
У металлов всегда положительная степень окисления.
- Щелочные металлы:
Li, Na, K, Rb, Cs, Fr С.О. + 1
- Элементы II группы (кроме Hg):
- Алюминий Аl С.О. +3
- Исключения:
- Пероксиды водорода и металлов
- Фторид кислорода:
- Гидриды активных металлов
- сформировать понятия “степень окисления”, “постоянная, переменная степень окисления” “бинарные соединения”;
- познакомиться с правилами определения степеней окисления, с номенклатурой и принципом составления названий бинарных соединений, с алгоритмом составления формул веществ по названиям.
Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd С.О. +2
Cu +2 ; Au +3
Минимальная С.О. = 8 — №группы (элемента)
Азот — элемент 5 группы: 8-5=3 N -3 H3
С.О. кислорода в большинстве соединений: -2
Исключения:
H +1 2O -1 2 , Na +1 2 O -1 2 , Ca +2 O -1 2
O +2 F -1 2
С.О. водорода в большинстве соединений: +1
Na +1 H -1 , Ca +2 H -1 2
Сумма степеней окисления в молекуле (ионе) = нулю (заряду иона)
[ N -3 H +1 4] +
(-3 ● 1 + 1 ● 4 = 1)
H +1 2 S +6 O -2 4
(-2 ● 4 + 6 ● 1 + 1 ● 2 = 0)
В.В.Олейникова, МБОУ ООШ № 8 п. Садового Муниципального образования Славянский р-н
vuzirossii.ru
Урок химии по теме «Степень окисления». 8-й класс
Разделы: Химия
Тип урока: усвоение новых знаний.
Цели урока:
1. Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентные полярные) состоят из ионов.
2. С.О. положительная “+” и отрицательная “-” ставится над знаками элементов перед цифрами, в том числе и единицей.
ПРАВИЛА:
- Степень окисления свободных атомов и простых веществ равна 0: (
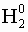 ; Mg 0 )
; Mg 0 ) - Степень окисления водорода в соединениях с неметаллами равна +1, а с металлами равна -1: (NaH -1 , H +1 Cl).
- Степень окисления фтора в соединениях всегда равна -1: (HF -1 , CaF -1 2).
- Степень окисления кислорода в соединениях равна -2 (NO -2 , Al2O -2 3), а в пероксидах -1 (H2O -1 2, O +1 F2)
- Степень окисления металлов в соединениях всегда положительная , у металлов I-A, II-A, III-A соответственно равна +1, +2, +3 .
- Суммарная степень окисления всех атомов в молекуле равна 0.
- Высшая степень окисления элемента равна (+№ группы).
- Низшая степень окисления: для металлов равна 0, для неметаллов равна (№ группы -8).
- Элементы в высшей степени окисления могут только принимать электроны
- Элементы в низшей степени окисления могут только отдавать электроны
- Элементы в промежуточной степени окисления могут и принимать, и отдавать электроны.
ЗАДАНИЕ:
(указывается в скобках римской цифрой)
элементы I-А, II-А, III-А– группы
Бинарные соединения (“би” – два) – состоят из двух химических элементов.
В соединениях на первом месте пишется элемент (или частица) с положительной степенью окисления, а на втором — с отрицательной с.о.
Алгоритм определения степеней окисления по формуле:
Расставить степени окисления в соединениях: Na; K2O; Fe; CaCO3; AlCl3; Li3N; BaSO4; Zn; H2CO3; O3; OF2; CuSO4; NaOH; O2; SO3; KH; KOH; BaH2; H2O; NH3.
НАЗВАНИЯ БИНАРНЫХ СОЕДИНЕНИЙ:
Пример: Al +3 2O -2 3 – оксид алюминия; Cu +2 O -2 – оксид меди (II)
Cl -1 – хлорид; O -2 – оксид; Н -1 – гидрид; S -2 – сульфид; C -4 – карбид; N -3 – нитрид; P -3 — фосфид; Si -4 — силицид.
Алгоритм составления формул по названиям:
Составить формулы веществ по названиям:
- хлорид кальция
- оксид железа (III)
- оксид азота (V)
- хлорид серы (IV)
- сульфид хрома (VI)
- гидрид магния
- карбид алюминия

xn--i1abbnckbmcl9fb.xn--p1ai
Понятие степень окисления
Для характеристики состояния элементов в соединениях введено понятие степени окисления.
Положительная степень окисления обозначает число электронов, которые смещаются от данного атома, а отрицательная – число электронов, которые смещаются к данному атому.
Из этого определения следует, что в соединениях с неполярными связями степень окисления элементов равна нулю. Примерами таких соединений могут служить молекулы, состоящие из одинаковых атомов (N2, H2, Cl2).
Степень окисления металлов в элементарном состоянии равна нулю, так как распределение электронной плотности в них равномерно.
В простых ионных соединениях степень окисления входящих в них элементов равна электрическому заряду, поскольку при образовании этих соединений происходит практически полный переход электронов от одного атома к другому: Na +1 I -1 , Mg +2 Cl -1 2, Al +3 F -1 3, Zr +4 Br -1 4.
При определении степени окисления элементов в соединениях с полярными ковалентными связями сравнивают значениях их электроотрицательностей. Поскольку при образовании химической связи электроны смещаются к атомам более электроотрицательных элементов, то последние имеют в соединениях отрицательную степень окисления.
Правила определения степени окисления
Чтобы определить степени окисления элементов, входящих в состав того или иного соединения, сначала необходимо разобраться с тем, для каких элементов эта величина точно известна.
Так, например, в соединениях с неполярными связями степень окисления элементов равна нулю. Примерами таких соединений могут служить молекулы, состоящие из одинаковых атомов (N2, H2, Cl2).
Фтор, характеризующийся наибольшим значением электроотрицательности, в соединениях всегда имеет постоянную отрицательную степень окисления (-1).
Для кислорода, также имеющего высокое значение электроотрицательности, характерна отрицательная степень окисления обычно (-2), в пероксидах (-1). Исключение составляет соединение состава OF2, в котором степень окисления кислорода равна (+2).
Щелочные и щелочноземельные элементы, для которых свойственно относительно невысокое значение электроотрицательности, всегда имеют положительную степень окисления, равную соответственно (+1) и (+2).
Постоянную степень окисления (+1) в большинстве соединений проявляет водород, напримерH +1 Cl -1 , H +1 2O -2 , P -3 H +1 3. Однако в гидридах степень окисления водорода – (-1), напримерLi +1 H -1 , Ca +2 H -1 2.
Большинство элементов могут проявлять разную степень окисления в соединениях. При определении их степени окисления пользуются правилом, согласно которому сумма степеней окисления элементов в электронейтральных молекулах равна нулю, а в сложных ионах – заряду этих ионов. В качестве примера рассчитаем степень окисления азота в соединениях состава KNO2 и HNO3. Степень окисления водорода и щелочных металлов в соединениях равна (+), а степень окисления кислорода – (-2). Соответственно степень окисления азота равна:
ru.solverbook.com
Степень окисления правила

Правила определения степеней окисления атомов в соединениях*
Правила определения степеней окисления атомов в соединениях*
Для того, чтобы уметь определять степени окисления атомов в соединениях, нужно знать следующие правила:
1) степень окисления атомов в простом веществе равна 0 . 0.
2) Есть элементы, атомы которых проявляют постоянные степени окисления (вы поймете почему, если вспомните строение их валентного уровня и учтете размер их атомов):
все щелочные металлы ( I A I A -подгруппа): + 1 +1 ;
* Материал для повторения
16 S [ N e ] 3 s 2 3 p 4 → — 6 e — → 16 S 6 + 1 s 2 2 s 2 2 p 6 16S [Ne]3s^23p^4 → -6e^- → 16S^ 1s^22s^22p^6 или [ N e ] [Ne]
4) Для элементов главных подгрупп работает правило «чётности-нечётности»: элементы главных подгрупп чётных групп проявляют, как пра-вило, чётные степени окисления, нечетных групп – нечетные.
5) Высшее значение степени окисления элемента (высшая степень окисления) обычно равно номеру группы. Например,
фтор – как уже говорилось, кроме нулевой, проявляет единственную степень окисления ( – 1 ) (–1) ;
6) Низшее значение степени окисления для металлов = 0 0 , для неметаллов V , V I , V I I V, VI, VII групп и углерода: № № группы минус 8 8 .
Например, для Р : V — 8 = — 3 Р: V — 8 = -3
для B r : V I I — 8 = — 1 Br: VII — 8 = -1
для S e : V I – 8 = — 2 Se: VI – 8 = -2
Исключение − бор, водород и благородные газы.
7) Сумма степеней окисления всех атомов в соединении равна 0, в ионе — заряду этого иона.
В бинарных соединениях (то есть в соединениях, состоящих из атомов двух разных элементов) степень окисления у атомов с большей электроотрицательностью отрицательна, а с меньшей — положительна.
Металлы в соединениях с неметаллами никогда не проявляют отрицательных степеней окисления — они все электроположительнее неметаллов!
zftsh.online
Как определить степень окисления?
Степень окисления — это формальный заряд атома. Слово «формальный» означает, что этого заряда у атома в действительности может и не быть, вернее, он может оказаться немного другим. Однако по разным причинам эти условные заряды удобны и химики всего мира пользуются понятием «степень окисления».
Отметим, что степень окисления указывается в верхнем правом углу атома в формате или , где – целое число. Например:
Существуют определённые правила нахождения степени окисления.
- Степень окисления простых веществ равна нулю. Напомню, что простыми называют вещества, состоящие из одного вида атомов. Примеры:
- Некоторые атомы в сложных соединениях проявляют только одну степень окисления. Такие степени окисления называются постоянными.
— Исключения у водорода соединения , в которых у водорода степень окисления
— Исключения у кислорода
- Сумма степеней окисления всех атомов сложного соединения должна быть равна нулю. Пользуясь именно эти правилом, мы будем расставлять степени окисления в сложных соединениях.
Как именно?Пример 1: расставьте степени окисления в соединении .
Мы знаем степень окисления тогда мы можем найти, что общее количество «плюсов» у четырех атомов . Чтобы в сумме был ноль, у трех атомов заряд должен быть , значит у каждого атомаПример 2: Найдите степени окисления всех атомов в соединении
Сначала подпишем постоянные степени окисленияПосчитаем общее количество плюсов и минусов
Для того, чтобы плюсов и минусов было одинаковое количество у двух хромов в сумме должно быть , а значит, у каждого атома
Пример 3: Найдите степени окисления всех атомов в соединении
Для начала заметим, что для нахождения степени окисления удобно «раскрыть скобки» и представить соединение как и тогда задание выполняется аналогично заданию из примера 2.
Ответ: - В некоторых устоявшихся группах атомов в составе веществ (кислотные остатки и ион аммония) степени окисления атомов неизменны и их тоже стоит запомнить.
Пользуясь этими правилами, можно расставить степени окисления практически во всех соединений, встречающихся на ЕГЭ по химии.
ege-study.ru
