главная > справочник > химическая энциклопедия:
Растворимость, способность вещества образовывать с другим веществом (или веществами) гомогенные смеси с дисперсным распределением компонентов (см. Растворы). Обычно растворителем считают вещество, которое в чистом виде существует в том же агрегатном состоянии, что и образовавшийся раствор. Если до растворения оба вещества находились в одном и том же агрегатном состоянии, растворителем считается вещество, присутствующее в смеси в существенно большем кол-ве.
Растворимость определяется физическим и химическим сродством молекул растворителя и растворяемого вещества, соотношением энергий взаимодействием однородных и разнородных компонентов раствора. Как правило, хорошо растворимы друг в друге подобные по физ. и хим. свойствам вещества (эмпирич. правило «подобное растворяется в подобном»). В частности, вещества, состоящие из полярных молекул, и вещества с ионным типом связи хорошо раств. в полярных растворителях (воде, этаноле, жидком аммиаке), а неполярные вещества хорошо раств. в неполярных растворителях (бензоле, сероуглероде).
Согласно теории, предложенной Дж. Гильдебрандом (1935), взаимная растворимость неэлектролитов возрастает с уменьшением разности их параметров растворимости d=(Е/V) 1/2 , где Е-теплота испарения, V-полярный объем. Параметр растворимости — одно из осн. понятий, определяющих когезионные свойства веществ в конденсир. состояниях; важная технол. характеристика полимеров и растворителей, лакокрасочных материалов и т.п. (см. Когезия). Р. мн. электролитов возрастает пропорционально кубу диэлектрич. проницаемости растворителя. Обычно более растворимы электролиты с большей склонностью к сольватации растворителем; образование кристаллогидратов обычно увеличивает растворимость солей.
Растворимость данного вещества зависит от температуры и давления соответствует общему принципу смещения равновесий (см. Ле Шателье-Брауна принцип). Концентрация насыщенного раствора при данных условиях численно определяет Р. вещества в данном растворителе и также наз. растворимостью. Пересыщенные растворы содержат большее кол-во растворенного вещества, чем это соответствует его растворимости, существование пересыщенных растворов обусловлено кинетич. затруднениями кристаллизации (см. Зарождение новой фазы). Для характеристики растворимости малорастворимых веществ используют произведение активностей ПА (для растворов, близких по своим свойствам к идеальному — произведение растворимости ПР).
Растворение газов в воде-экзотермич. процесс, поэтому с ростом температуры Р. газов в воде уменьшается. В орг. растворителях газы часто раств. с поглощением тепла и с ростом температуры растворимость газов повышается. В некоторых случаях на кривых зависимости растворимости газов от температуры наблюдается минимум (напр., система водород-вода). При постоянной температуре в случае образования идеального разбавленного бинарного раствора неэлектролита растворимость газа (молярная доля в растворе) пропорциональна его парциальному давлению над раствором (см. Генри закон). С ростом давления для определения Р. газа необходимо учитывать отклонение его свойств от свойств идеального газа, что достигается заменой парциального давления летучестью.
Системы жидкость — жидкость (жидкие смеси) различаются по следующим типам: жидкости смешиваются друг с другом во всех отношениях (напр., система вода — этанол); жидкости практически нерастворимы друг в друге (вода-ртуть); жидкости частично растворимы друг в друге (вода-диэтиловый эфир). С ростом температуры взаимная Р. жидкостей в большинстве случаев увеличивается и, если не достигается температура кипения, существует температура, при которой обе жидкости смешиваются друг с другом в любых соотношениях, — так называемая критическая температура растворимости, или верхняя критическая точка смешения (ВКТС). Если достигается температура кипения, осуществляется трехфазное равновесие с участием паровой фазы и двух жидких фаз-паровая эвтектика или паровая перитектика. В некоторых системах взаимная растворимость повышается с понижением температуры и возможно достижение нижней критической температуры смешения (HKTС). Известны системы (напр., вода-трибутилфосфиноксид), где имеется и верхняя и нижняя критические точки (см. Критическое состояние). Обычно область расслаивания жидкой смеси при понижении температуры пересекается с линией ликвидуса с образованием монотектич. или синтектич. фазового равновесия (см. Диаграмма состояния).
Влияние давления на растворимость зависит от того, как изменяется с давлением молярный объем вещества и его парциальный молярный объем в растворе. Если при некотором давлении молярный объем вещества становится меньше его парциального молярного объема, растворимость вещества с ростом давления снижается. Такая закономерность характерна для неполярных растворителей; например, растворимость гексахлорэтана в сероуглероде при 500 МПа меньше, чем при 0,1 МПа, в 15 раз. Для газов при высоких давлениях на кривой зависимости растворимости от давления имеется максимум. Для электролитов на зависимость растворимости от давления сказывается изменение молярного объема вследствие сольватации ионов молекулами растворителя. Взаимная растворимость жидкостей мало зависит от давления, зависимость становится заметной при давлениях порядка неск. ГПа.
Вещество, способное растворяться в двух неограниченно смешивающихся друг с другом растворителях, распределяется между ними так, что отношение его активностей в этих растворителях а1 и а2 при постоянной температуре остается постоянным, независимо от общего кол-ва растворенного вещества: a1/a2 = К, где К — коэффициент распределения (закон Бертло-Нернста). Для сильно разбавленных растворов вместо отношения активностей компонентов можно записать отношение их концентраций.
Растворение твердых тел в жидкостях может сопровождаться поглощением тепла, в этом случае повышение температуры приводит к увеличению растворимости Если образуется идеальный раствор, зависимость растворимости от температуры записывается уравнением Шредера

где DHпл и Тпл – энтальпия плавления и температура плавления растворенного вещества. Если энергия сольватации больше энергии, необходимой для разрушения кристаллической решетки, растворение является экзотермическим процессом и растворимость с ростом температуры понижается. У некоторых веществ (напр., гипс) наблюдается минимум на кривой зависимости растворимости от температуры. При образовании твердых растворов максимум растворимости достигается, как правило, при температуре трехфазного равновесия — эвтектического или перитектического. Но в некоторых системах максимум растворимость отвечает более высокой температуре (системы с ретроградной растворимостью).
Растворимость изучают изотермическими или политермическими методами (см. Термический анализ). Полученные результаты представляют в виде диаграмм расвторимости, которые являются частным случаем диаграммы состояния. Объемное изображение фазовых состояний системы в пространстве параметров состояния (температуры и составов различных фаз) сводят специальными приемами к фигурам на плоскости. Для тройной системы из двух солей и воды используют обычный концентрационный треугольник, вершины которого отвечают чистым компонентам (см. Многокомпонентные системы). Применяют также изображение растворимости по способу Шрейнемакерса (Ф. Схрейнемакерс), при котором вершина прямоугольной системы координат отвечает чистой воде, а по обеим осям откладывают концентрации солей, выраженные кол-вом той или другой соли на определенное кол-во воды (1 моль). Точки, отвечающие чистым солям, лежат в бесконечности (см. рис. а). Др. прием построения диаграмм растворимости на плоскости — способ Йенеке (см. рис. б): на оси абсцисс отражается состав солевой массы раствора, т.е. соотношение концентраций солей, а по оси ординат откладывается кол-во воды на определенное кол-во растворенных веществ (напр., 1 моль). В этом способе в бесконечности находится точка, отвечающая чистой воде. На диаграммах (см. рис. а и б) буквой Ж обозначено фазовое поле гомог. системы (р-ра), Ж+А и Ж+В- фазовые поля пересыщенных растворов, Ж + А + В — тройная пересыщенная система; линии А’E отвечают растворам, насыщ. компонентом А (концентрация насыщения при данном содержании В), линии ЕB’-р-рам, насыщенным компонентом В, Е-эвтонич. точка системы (эвтоника), отвечающая составу раствора, насыщенного двумя компонентами (аналог эвтектики на диаграммах плавкости). Точка эвтоники характеризуется макс. концентрацией растворенных веществ в растворе, миним. парциальным давлением пара растворителя над раствором, постоянством состава раствора и давления пара при изотермич. испарении вплоть до окончат. высыхания системы.

Изотермическая диаграмма растворимости тройной системы соль А — соль В — вода с изображением по способу Шрейнемакерса (а) и по способу Йенеке (б). Пояснения в тексте.
Использование диаграмм расвторимости позволяет установить сосуществующие фазы при данной температуре и соответствующие им составы растворов, провести расчеты процессов испарения, кристаллизации из растворов и т. п., что необходимо для обоснования многих технологических схем. Например, диаграмма растворимости системы KCl-NaCl-H2O является основой технологии переработки сильвинитов, системы K2SO4-MgCl2-H2O-переработки полиминеральных галургических руд.
Лит.: Новоселова А. В., Методы исследования гетерогенных равновесий, М., 1980; Ксензенко В. И., Кононова Г. Н., Теоретические основы переработки галургического сырья, М., 1982. © П. И. Федоров.
выберите первую букву в названии статьи: А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Ш Щ Э Ю Я
www.chemport.ru
Коэффициент растворимости







«к+Тоо’100%’ Растворимость веществ, которая в различных растворителях меняется в широких пределах, определяется рядом факторов. Первый из них — увеличение хаотичности, неупорядоченности при образовании растворов, способствует переходу растворенного вещества в раствор. Второй фактор — энергетические затраты на отрыв частиц от кристаллической решетки растворяемого вещества и возрастание энергии при растворении. Энергетический фактор препятствует переходу растворенного вещества в раствор. Значение равновесной концентрации растворенного вещества в растворе будет определяться совместным действием этих двух факторов. В свою очередь, влияние названных факторов зависит от природы растворителя, природы растворяемых веществ, их агрегатного состояния и внешних условий (температуры, давления и др.). Анализ зависимости растворимости любого вещества в растворителях различной природы наглядно иллюстрирует влияние на растворимость природы растворителя. Влияние природы растворяемых веществ можно показать на следующих примерах. Так, почти все соли щелочных металлов и аммония хорошо растворимы в воде, например нитраты, хлориды (кроме хлоридов серебра, ртути, свинца) и сульфаты (кроме сульфатов щелочноземельных металлов и свинца). Для переходных металлов характерна небольшая растворимость сульфидов, фосфатов, карбонатов и некоторых других солей, а также их гидроксидов. Более подробно влияние этого фактора иллюстрирует таблица растворимости веществ (см. Приложение). Анализируя растворимость веществ различного агрегатного состояния, следует отметить, что при растворении твердых и жидких веществ объем раствора обычно изменяется незначительно. Поэтому растворимость твердых и жидких веществ, как правило, не зависит от давления. При растворении газообразных веществ объем системы существенно уменьшается, и это предопределяет зависимость их растворимости от давления, причем повышение давления в соответствии с принципом Jle Шателье приводит к увеличению растворимости газа. Растворимость веществ во всех агрегатных состояниях зависит от температуры. Как, правило, растворимость твердых веществ с увеличением температуры возрастает (AgN03, KI, NH4C1). Однако имеются вещества, растворимость которых при увеличении температуры возрастает очень незначительно (NaCl) или даже уменьшается (Са(ОН)2, Li2S04, Са(СН3СОО)2. По принципу Jle Шателье между веществом в кристаллическом состоянии и его насыщенным раствором имеет место равновесие: кристалл + растворитель насыщенный раствор ± ДН В тех случаях, когда процесс растворения эндотермичен, т. е. количество энергии, идущей на разрушение кристаллической решетки веществ не полностью компенсируется энергией, выделяющейся при образовании гидратов (сольва-тов), повышение температуры ведет к увеличению растворимости. Ясно, что экзотермичность процесса растворения приведет к понижению растворимости при повышении температуры. Зависимость между растворимостью и температурой изображают как в виде табличных данных, так и в графической форме — в виде кривых растворимости. Рассматривая растворимость жидкостей, отметим, что некоторые из них смешиваются с растворителем в любых соотношениях, например спирт и вода, другие — ограниченно растворимы — бензол и вода. В случае ограниченной растворимости жидкости взаимно растворимы друг в друге до насыщения при данной температуре. Так, если смешать гексан с водой, то образуется два слоя: верхний представляет собой насыщенный раствор воды в гексане, а нижний — насыщенный раствор гексана в воде. В большинстве подобных случаев с повышением температуры взаимная растворимость жидкостей увеличивается до тех пор, пока не будет достигнута температура, при которой обе жидкости смешиваются в любых пропорциях. Растворение газов почти всегда сопровождается выделением теплоты. Согласно принципу Jle Шателье, повышение температуры понижает растворимость газов, поэтому при кипячении газы полностью удаляится из растворов. Решение задач по теме ♦ Растворимость» водится или к определению растворимости веществ в изотермических условиях (по известным данным о содержании раство- ренного вещества), или к определению количества вещества, выпадающего в осадок, либо растворяющегося в системе «вещество-растворитель» при изменении температуры раствора. Пример 1 Определить растворимость и массовую долю (%) насыщенного раствора хлорида калия, если 20 мл его имеют массу 20,94 г и содержат 3,25 г соли. Дано: У(Р-Ра) = 20 мл т(р-ра) — 20,94 г т(КС1) = 3,25 и Найти: w %; К(КС1) Решение: 1) Зная массу раствора (20,94 г) и массу растворенного вещества (3,25 г), найдем массу растворителя: 20,94 г — 3,25 г-17,69 г. 2) Определим коэффициент растворимости соли: в 17,69 г Н20 — 3,25 г соли в 100 гН20-хг соли *
18’37 г’ 3) Определим массовую долю (%) хлорида калия в насыщенном растворе по формуле: w = ТосГ+к»‘100 % = 18 37 100% =15,52%. 118,37 Ответ: iv(KC\) — 15,52 %; К(КС1)= 18,37 г. Пример 2 Какое количество сульфата калия необходимо добавить к 400 г насыщенного при 20 °С раствора, чтобы при нагревании до 100 °С раствор остался насыщенным? Массовая доля (%) насыщенного при 20 °С раствора сульфата калия равна 10 %, а при 100 °С — 19,4%. Дано: tx = 20 °С *2= 100 °С т(р-ра) = 400 г wx = 10% iv2 = 19,4% Найти: /n(K2S04) Решение: 1) Определим количественный состав 400 г раствора, насыщенного при 20 °С по формуле: т(в-ва) со ——7-7-100%, т(р-ра) откуда w % • т(р-ра) га(в-ва)= — 100 % следовательно, 10%-400 г тт?(соли) ———;— = 40 г. 100 % Отсюда видно, что 40 г соли содержатся в 400 г р-ра или в 360 г растворителя. Поскольку при изменении температуры масса растворителя не меняется, остается узнать, какое количество соли будет содержаться в 360 г воды при насыщении раствора до 100 °С. 2) Исходя из знания массовой доли (%) насыщенного раствора K2S04 при 100 °С (19,4), видим, что 19,4 г K2S04 содержится в 100 г раствора или в 80,6 г растворителя. Найдем количество соли в 360 г воды: в 80,6 г Н20 — 19,4 г K2S04 в 360 г Н20 — jc г K2S04 *
96,65 Г’ 3) Рассчитаем количество соли, которое необходимо добавить к раствору при 20 °С, чтобы он остался насыщенным при 100 °С: Вопросы и задачи для самостоятельного решения L Какой взгляд на природу растворов предложил Д. И. Менделеев, в каких фактах он видел подтверждение своей теории? 2. Каковы современные взгляды на процесс растворения? 3. Какие факторы влияют на растворимость веществ? 4. Какую роль в процессе растворения играет растворитель и чем объясняется избирательность его действия на растворимые вещества? 5. Как можно объяснить различные значения тепловых эффектов процесса растворения твердых веществ? 6. Что следует понимать под терминами «растворимость», ♦ коэффициент растворимости»? 7. В какой зависимости находятся коэффициенты растворимости твердых веществ от температуры, как эту зависимость обычно выражают? Растворимость дихромата калия при 20 °С составляет 11,0 г. Определите массовую долю (%) насыщенного раствора соли. Ответ: 9,91 %. 9. Массовая доля (%) насыщенного при 20 °С раствора нитрата бария равна 8,25%. Найдите коэффициент растворимости соли. Ответ: 9 г. 10. При охлаждении 500 г раствора с массовой долей соли 12 % часть растворенного вещества выпала в осадок и концентрация раствора стала равной 8 %. Чему равна масса выпавшей в осадок соли? Ответ: 21,8 г. 11. При охлаждении насыщенного при 80 °С раствора до 20 °С выкристаллизовалось 150 г соли. Какова была масса исходного раствора, если растворимость соли при 80 и 20 °С соответственно составляет 35 и 6,5 г? Ответ: 710,5 г. 12. Определить концентрацию раствора и количество воды, в которой можно растворить при 40 °С 200 г соли, содержащей 80 % сульфата калия, если растворимость сульфата калия при этой температуре равна 64 г. Ответ: 39 %; 250 г. 13. Определить количество воды, в которой можно растворить при 80 °С 950 г соли, содержащей 84,58 % кристаллогидрата хлорида магния, если растворимость безводного хлорида магния при этой температуре равна 66 г. Ответ: 569^7 г. 14. Растворимость сульфата меди при 20 °С равна 20,2 г, а при 100 °С— 77 г. Определите массу сульфата меди, выпадающего в осадок при охлаждении 165 г раствора от 100 до 20 °С. Ответ: 54,2 г. 15. Растворимость хлората калия при 70 °С равна 30,2 г, а при 30 °С — 10,1 г. Определите массу соли, выпадающей в осадок при охлаждении до 30 °С 350 г насыщенного при 70 °С раствора. Ответ: 54 г.
natalibrilenova.ru
Правило растворимости веществ










Растворы играют очень важную роль в природе, науке к технике. Вода, столь широко распространенная я природе, всегда содержит растворенные вещества. В пресной воде рек и озер их мало, в то время как в морской воде содержится около 3.6% растворенных солей.
В первичном океане (во время появления жизни на Земле) массовая доля солей, по предположениям, была низка, около 1 %.
Именно в этом растворе впервые развились живые организмы, и из ятого рнстнора они получили ноны и молекулы, необходимые дли их роста и жизни. С течением времени живые организмы риз пинались и изменялись. ЧТО позволило им покинуть водную среду и перейти на сушу и затем подняться н воздух. Они приобрели эту способность, сохранин и своих организмах водный раствор в виде жидкостей, содержащих необходимый запас ионов и молекул» — вот так оценивает роль растворов в возникновении и развитии жизни на Земле известный американский химик, лауреат Нобелевской премии Лайнус Полинг Внутри нас, в каждой вашей клеточке — воспоминание о первичном океане, в котором зародилась жизнь, — водном растворе, обеспечивающем саму жизнь.
В каждом живом организме бесконечно течет по сосудам — артериям, венам и капиллярам — волшебный раствор, составляющий основу крови, массовая доля солей в нем такая же, как в первичном океане. — 0,0%. Сложные физико-химические процессы, происходящие в организмах человека и животных, также протекают в растворах. Усвоение нищи связано с переводом питательных веществ в раствор. Природные водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. Многие технологические процессы в химической и других отраслях промышленности, например получения соды, удобрений, кислот, металлов, бумаги, протекают в растворах. Изучение свойств растворов занимает очень важное место в современной науке. Так что же такое раствор?
Отличие раствора от других смесей в том. что частицы составных частей распределяются в нем равномерно, и в любом микрообъеме такой смеси состав одинаков.
Поэтому под растворами понимали однородные смеси, состоящие из двух или более однородных частей. Это представление исходило пз физической теории растворов.
Сторонники физической теории растворов, которую развивали Вант Гофф, Лррениус и Оствальд, считали, что процесс растворения является результатом диффузии, то есть проникновения, растворенного вещества в промежутки между молекулами воды.
В противоположность представлениям физической теории растворов. Д. И. Менделеев и сторонники химической теории растворов доказывали, что растворение является результатом химического взаимодействия растворенного вещества с молекулами воды. Поэтому правильнее (точнее) определять раствор как однородную систему, состоящую из частиц растворенною вещества, растворителя и продуктов их взаимодействия.
В результате химического взаимодействия растворенного вещества с водой образуются соединения гидраты. О химическом взаимодействии говорят такие признаки химических реакций, как тепловые явления при растворении. Например, вспомните, что растворение серной кислоты в воде протекает с выделением такого большого количества теплоты, что раствор может закипеть, а потому льют кислоту в воду (а не наоборот). Растворение других веществ, например хлорида натрия, нитрата аммония, сопровождается поглощением теплоты.
М. В. Ломоносов установил, что растворы замерзают при более низкой температуре, чем растворитель. В 1764 г. он писал: «Морозы соленого рассолу не могут в лед превратить удобно, как одолевают пресного».
Гидраты — это непрочные соединения, существующие в растворе- Косвенным доказательством гидратации является существование твердых кристаллогидратов — солей, в состав которых входит вода. Ее в этом случае называют кристаллизационной. Например, к кристаллогидратам относится хорошо известная сачь голубого цвета — медный кунорос СиЗО, 5НгО. Безводный сульфат меди (И) — кристаллы белого цвета. Изменение цвета сульфата меди на голубой ири растворении его в воде и существование голубых кристаллов медного купороса является еще одним доказательством гидратной теории Д. И Менделеева.
В настоящее время принята теория, которая объединяет обе точки зрения, — физико-химическая теория растворов. Ее предсказывал еще в 1906 г. Д. И. Менделеев в своем замечательном учебнике «Основы химии»: «Две указанные стороны растворения и гипотезы, до сих пор приложенные к рассмотрению растворов, хотя имеют отчасти различные исходные точки, но без всякого сомнения, по всей вероятности, приведут к общей теории растворов, потому что одни общие законы управляют как физическими, так и химическими явлениями».
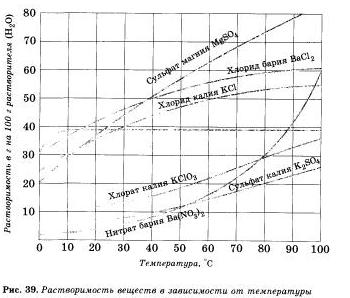
Растворимость веществ в воде зависит от температуры. Как правило, растворимость твердых веществ в воде увеличивается с повышением температуры, а растворимость ионов — уменьшается, поэтому волу можно почти полностью освободить от растворенных в ней газов кипячением. Если растворять в воде хлорид калия КО. применяющийся как удобрение, то при комнатной температуре (20 ºС) может раствориться только 34,4 г соли в 100 г воды; сколько бы не перемешивали раствор с остатком нерастворивгаейся соли, больше соли не растворится — раствор будет насыщен этой солью при данной температуре.
Насыщенным называется такой раствор, в котором при данной температуре вещество больше не растворяется.
Если же при этой температуре в 100 г воды растворить хлорида калия меньше, чем 34,4 г, то раствор будет ненасыщенным.
Ненасыщенным называется такой раствор, в котором при данной температуре находится меньше растворяемого вещества, чем в его насыщенном растворе.
При охлаждении насыщенного раствора возникает избыток растворенного вещества, если оно не выпадет в осадок, то образуется пересыщенный раствор.
Пересыщенным называется такой раствор, в котором при данной температуре находится в растворенном состоянии больше вещества, нем в его насыщенном растворе при тех же условиях.
Некоторыг вещества сравнительно легко дают пересыщенные растворы. К ним относятся, например, кристаллогидраты — глауберова соль и медный купорос.
Пересыщенные растворы готовят так. Приготавливают насыщенный раствор соли при высокой температуре, например при температуре кипения. Избыток соли отфильтровывают, накрывают колбу с горячим фильтратом ватой к осторожно, избегая сотрясений, медленно охлаждают при комнатной температуре. Приготовленный таким образом раствор, предохраняемый от толчков и попадания пыли, может храниться довольно долго. Но стоит только в такой пересыщенный раствор внести стеклянную палочку, на кончике которой имеется несколько крупинок этой соли, как немедленно начнется ее кристаллизация из раствора.
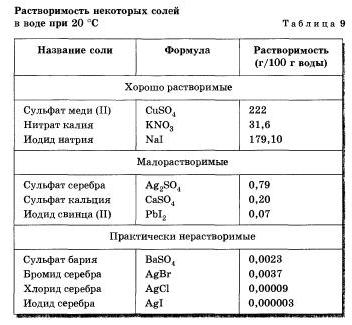
Глауберова соль широко используется в качестве сырья на химических заводах. Добывают ее энной в заливе Кара-Богаз-Гол, который сравнительно изолирован от Каспийского моря. Летом из-за высокой Скорости испарения воды шин заполняется сильно концентрированным раствором соли. Зимой, в связи с понижением температуры, растворимость ее уменьшается и соль кристаллизуется, что н лежит в основе се добычи. Летом кристаллы соли растворяются и добыча ее прекращается. При работе с различными веществами важно шать их рас-творимоегь в воде. Вещество считается хорошо растворимым, если при комнатной температуре в 100 г воды растворяется больше 1 г »гого вещества. Если при таких условиях растворяется меньше 1 г вещества в 100 г воды, то такое вещество считается малорастяоримым. К веществам практически нерастворимым относятся такие, растворимость которых меньше 0,01 г в 100 г воды.
2. Физическая и химический теории пасторов.
3. Тепловые явления при растворений.
4. Гидраты и кристаллогидраты; кристаллизационная вода
5. Насыщенные, ненасыщенные н пересыщенные растворы
6. Хорошо растворимые, чалорастноричые и практически нерастворимые вещества.
Почему в горячем чае кусочек сахара растворяется быстрее, чем в холодном?
Приведите примеры хорошо растворимых, малорастворимых и практически нерастворимых в воде веществ различных классов, пользуясь таблицей растворимости.
Почему аквариумы нельзя заполнять быстро охлажденной прокипяченной водой (они должна постоять несколько дней)?
Почему ранки, промытые водой, в которую были помещены серебряные изделия, заживают быстрее?
Пользуясь рисунком 39, определите массовую долю хлорида калия, содержащегося в насыщенном растворе при 20 °С.
Может ли разбавленный раствор быть одновременно п насыщенным?
К 500 г насыщенного при 20 °С раствора сульфита магния прилили достаточный для проведения реакции объем раствора хлорида бария. Найдите массу выпавшего осадка.
Если у вас есть исправления или предложения к данному уроку, напишите нам.
Если вы хотите увидеть другие корректировки и пожелания к урокам, смотрите здесь — Образовательный форум.
edufuture.biz
РАСТВОРИМОСТЬ
РАСТВОРИМОСТЬ, способность в-ва образовывать с др. в-вом (или в-вами) гомог. смеси с дисперсным распределением компонентов (см. Растворы). Обычно растворителем считают в-во, к-рое в чистом виде существует в том же агрегатном состоянии, что и образовавшийся р-р. Если до растворения оба в-ва находились в одном и том же агрегатном состоянии, р-рителем считается в-во, присутствующее в смеси в существенно большем кол-ве.
Р астворимость определяется физ. и хим. сродством молекул р-рителя и растворяемого в-ва, соотношением энергий взаимод. однородных и разнородных компонентов р-ра. Как правило, хорошо раств. друг в друге подобные по физ. и хим. св-вам в-ва (эмпирич. правило «подобное раств. в подобном»). В частности, в-ва, состоящие из полярных молекул, и в-ва с ионным типом связи хорошо раств. в полярных р-рителях (воде, этаноле, жидком аммиаке), а неполярные в-ва хорошо раств. в неполярных р-рителях (бензоле, сероуглероде).
Согласно теории, предложенной Дж. Гильдебрандом (1935), взаимная растворимость неэлектролитов возрастает с уменьшением разности их параметров растворимости d =(Е/V) 1/2 , где Е-теплота испарения, V-полярный объем. Параметр р-римости — одно из осн. понятий, определяющих когезион-ные св-ва в-в в конденсир. состояниях; важная технол. характеристика полимеров и р-рителей, лакокрасочных материалов и т.п. (см. Когезия). Растворимость мн. электролитов возрастает пропорционально кубу диэлектрич. проницаемости р-рителя. Обычно более растворимы электролиты с большей склонностью к сольватации р-рителем; образование кристаллогидратов обычно увеличивает растворимость солей.
Р астворимость данного в-ва зависит от т-ры и давления соотв. общему принципу смещения равновесий (см. Ле Шателье-Брауна принцип). Концентрация насыщ. р-ра при данных условиях численно определяет растворимость в-ва в данном р-рителе и также наз. растворимостью. Пересыщенные р-ры содержат большее кол-во растворенного в-ва, чем это соответствует его растворимости, существование пересыщенных р-ров обусловлено кинетич. затруднениями кристаллизации (см. Зарождение новой фазы). Для характеристики растворимости малорастворимых в-в используют произведение активностей ПА (для р-ров, близких по своим св-вам к идеальному,-произведение р-римости ПР).
Растворение газов в воде-экзотермич. процесс, поэтому с ростом т-ры растворимость газов в воде уменьшается. В орг. р-рителях газы часто раств. с поглощением тепла и с ростом т-ры растворимость газов повышается. В нек-рых случаях на кривых зависимости р-римости газов от т-ры наблюдается минимум (напр., система водород-вода). При постоянной т-ре в случае образования идеального разб. бинарного р-ра неэлектролита растворимость газа (молярная доля в р-ре) пропорциональна его парциальному давлению над р-ром (см. Генри закон). С ростом давления для определения растворимости газа необходимо учитывать отклонение его св-в от св-в идеального газа, что достигается заменой парциального давления летучестью.
Системы жидкость — жидкость (жидкие смеси) различаются по след. типам: жидкости смешиваются друг с дру гом во всех отношениях (напр., система вода — этанол); жидкости практически нерастворимы друг в друге (вода-ртуть); жидкости частично растворимы друг в друге (вода-диэтиловый эфир). С ростом т-ры взаимная растворимость жидкостей в большинстве случаев увеличивается и, если не достигается т-ра кипения, существует т-ра, при к-рой обе жидкости смешиваются друг с другом в любых соотношениях,-т. наз. критич. т-ра р-римости, или верх. критич. точка смешения (ВКТС). Если достигается т-ра кипения, осуществляется трехфазное равновесие с участием паровой фазы и двух жидких фаз-паровая эвтектика или паровая перитектика. В нек-рых системах взаимная растворимость повышается с понижением т-ры и возможно достижение ниж. критич. т-ры смешения (HKTС). Известны системы (напр., вода-трибу-тилфосфиноксид), где имеется и верхняя и нижняя критич. точки (см. Критическое состояние). Обычно область расслаивания жидкой смеси при понижении т-ры пересекается с линией ликвидуса с образованием монотектич. или синтек-тич. фазового равновесия (см. Диаграмма состояния).
Влияние давления на растворимость зависит от того, как изменяется с давлением молярный объем в-ва и его парциальный молярный объем в р-ре. Если при нек-ром давлении молярный объем в-ва становится меньше его парциального молярного объема, растворимость в-ва с ростом давления снижается. Такая закономерность характерна для неполярных р-рителей; напр., растворимость гексахлорэтана в сероуглероде при 500 МПа меньше, чем при 0,1 МПа, в 15 раз. Для газов при высоких давлениях на кривой зависимости растворимости от давления имеется максимум. Для электролитов на зависимости растворимости от давления сказывается изменение молярного объема вследствие сольватации ионов молекулами р-рителя. Взаимная растворимость жидкостей мало зависит от давления, зависимость становится заметной при давлениях порядка неск. ГПа.
В-во, способное раств. в двух неограниченно смешивающихся друг с другом р-рителях, распределяется между ними так, что отношение его активностей в этих р-рителях а1 и а2 при постоянной т-ре остается постоянным, независимо от общего кол-ва растворенного в-ва: a1/a2 = К, где К — коэф. распределения (закон Бертло-Нернста). Для сильно разб. р-ров вместо отношения активностей компонентов можно записать отношение их концентраций.
Растворение твердых тел в жидкостях может сопровождаться поглощением тепла, в этом случае повышение т-ры приводит к увеличению растворимости. Если образуется идеальный р-р, зависимость растворимости от т-ры записывается ур-нием Шредера
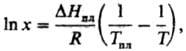
где D Hпл и Тпл -энтальпияплавления и -т-ра плавления растворенного в-ва. Если энергия сольватации больше энергии, необходимой для разрушения кристаллич. решетки, растворение является экзотермич. процессом и растворимость с ростом т-ры понижается. У нек-рых в-в (напр., гипс) наблюдается минимум на кривой зависимости растворимости от т-ры. При образовании твердых растворов максимум растворимости достигается, как правило, при т-ре трехфазного равновесия — эвтектического или перитектического. Но в нек-рых системах максимум растворимости отвечает более высокой т-ре (системы с ретроградной растворимостью).
Р астворимость изучают изотермич. или политермич. методами (см. Термический анализ). Полученные результаты представляют в виде диаграмм растворимости, к-рые являются частным случаем диаграммы состояния. Объемное изображение фазовых состояний системы в пространстве параметров состояния (т-ры и составов разл. фаз) сводят спец. приемами к фигурам на плоскости. Для тройной системы из двух солей и воды используют обычный концентрац. треугольник, вершины к-рого отвечают чистым компонентам (см. Многокомпонентные системы). Применяют также изображение растворимости по способу Шрейнемакерса (Ф. Схрейнемакерс), при к-ром вершина прямоугольной системы координат отвечает чистой воде, а по обеим осям откладывают концентрации солей, выраженные кол-вом той или другой соли на определенное кол-во воды (1 моль). Точки, отвечающие чистым солям, лежат в бесконечности (см. рис. а). Др. прием построения диаграмм растворимости на плоскости — способ Йенеке (см. рис. б): на оси абсцисс отражается состав солевой массы р-ра, т.е. соотношение концентраций солей, а по оси ординат откладывается кол-во воды на определенное кол-во растворенных в-в (напр., 1 моль). В этом способе в бесконечности находится точка, отвечающая чистой воде. На диаграммах (см. рис. а и б) буквой Ж обозначено фазовое поле гомог. системы (р-ра), Ж+А и Ж+В- фазовые поля пересыщенных р-ров, Ж + А + В — тройная пересыщенная система; линии А’E отвечают р-рам, насыщ. компонентом А (концентрация насыщения при данном содержании В), линии ЕB’-р-рам, насыщенным компонентом В, Е-эвто-нич. точка системы (эвтоника), отвечающая составу р-ра, насыщенного двумя компонентами (аналог эвтектики на диаграммах плавкости). Точка эвтоники характеризуется макс. концентрацией растворенных в-в в р-ре, миним. парциальным давлением пара р-рителя над р-ром, постоянством состава р-ра и давления пара при изотермич. испарении вплоть до окончат. высыхания системы.
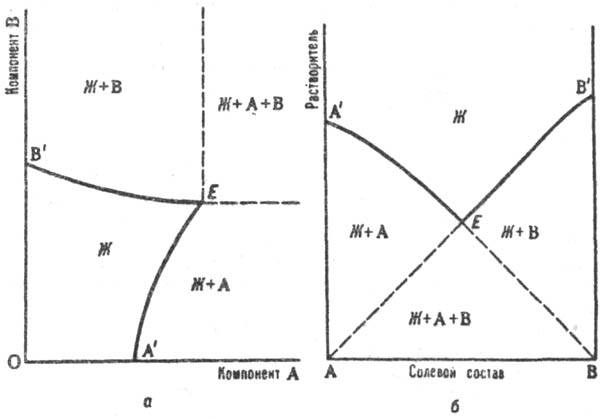
Изотермич. диаграмма р-римости тройной системы соль А — соль В — вода с изображением по способу Шрейнемакерса (а) и по способу Йенеке (б). Пояснения в тексте.
Использование диаграмм растворимости позволяет установить сосуществующие фазы при данной т-ре и соответствующие им составы р-ров, провести расчеты процессов испарения, кристаллизации из р-ров и т. п., что необходимо для обоснования многих технол. схем. Напр., диаграмма растворимости системы KCl-NaCl-H2O является основой технологии переработки сильвинитов, системы K2SO4-MgCl2-H2O-переработки полиминеральных галургич. руд.
Лит.: Новоселова А. В., Методы исследования гетерогенных равновесий, М., 1980; Ксензенко В. И., Кононова Г. Н., Теоретические основы переработки галургического сырья, М., 1982. П. И. Федоров.
www.xumuk.ru
