
Правила заполнения электронных оболочек и составление электронных конфигураций атомов
Правила заполнения электронных оболочек и составление электронных конфигураций атомов
Распределение электронов по атомным орбиталям (АО) происходит в соответствии с принципом наименьшей энергии, принципом Паули и правилом Гунда.
1. Принцип наименьшей энергии требует, чтобы электроны заселяли АО в порядке увеличения их энергии: в первую очередь заполняются уровни и подуровни с наиболее низкой энергией и далее – подуровни по мере роста их энергии.
Это отражает общие термодинамические тенденции – максимуму устойчивости системы соответствует минимум её энергии. Самым низким по энергии, как уже говорилось, является первый, ближайший к ядру энергетический уровень с n = 1.
В многоэлектронных атомах электрон взаимодействует не только с ядром (электростатическое притяжение), но и с другими электронами (электро-статическое отталкивание). В этом случае его энергия определяется не только главным n, но и орбитальным l квантовыми числами. Орбитальное число определяет форму орбиталей, и чем сложнее их форма, тем выше энергия
подуровня который они составляют. Таким образом, при одном и том же значении n энергия возрастает с ростом l : ns ≈ \approx 4f ≈ \approx 5f ½ + ½ + ½ = 1 ½ . ½+½+½ = 1 ½.
Если бы электроны расположились так:
то суммарный спин был бы равен ½ – – ½ + + ½ = = ½.
Правило Гунда выведено на основании изучения атомных спектров.
Квантово-механическая природа этого правила основана на том, что электроны с разными значениями ml (в нашем примере – 1 ; –1; 0 0 ; + 1 +1 ) наиболее пространственно удалены друг от друга и энергия их электростатического отталкивания минимальна.
Как следствие, на одной орбитали не может находиться более двух элек-тронов. При этом их спины будут противоположными.
Все вышеизложенные правила определяют энергию электрона, электрон-ную конфигурацию атома и местоположение элемента в Периодической сис-теме Д.И. Менделеева.
zftsh.online
Пять d – орбиталей
На первом энергетическом уровне ( n = 1) орбитальное квантовое число l принимает единственное значение l = ( n — 1) = 0. Форма обитали — сферическая; на первом энергетическом только один подуровень — 1 s . Для второго энергетического уровня ( n = 2) орбитальное квантовое число может принимать два значения: l = 0, s — орбиталь — сфера большего размера, чем на первом энергетическом уровне; l = 1, p — орбиталь — гантель. Таким образом, на втором энергетическом уровне имеются два подуровня — 2 s и 2 p . Для третьего энергетического уровня ( n = 3) орбитальное квантовое число l принимает три значения: l = 0, s — орбиталь — сфера большего размера, чем на втором энергетическом уровне; l = 1, p — орбиталь — гантель большего размера, чем на втором энергетическом уровне; l = 2, d — орбиталь сложной формы.
Таким образом, на третьем энергетическом уровне могут быть три энергетических подуровня — 3 s , 3 p и 3 d .
Магнитное квантовое число ( m ) характеризует положение электронной орбитали в пространстве и принимает целочисленные значения от — I до + I , включая 0. Это означает, что для каждой формы орбитали существует (2 l + 1) энергетически равноценных ориентации в пространстве.
Для s — орбитали ( l = 0) такое положение одно и соответствует m = 0. Сфера не может иметь разные ориентации в пространстве.
Для p — орбитали ( l = 1) — три равноценные ориентации в пространстве (2 l + 1 = 3): m = -1, 0, +1.
Для d — орбитали ( l = 2) — пять равноценных ориентаций в пространстве (2 l + 1 = 5): m = -2, -1, 0, +1, +2.
Таким образом, на s — подуровне — одна, на p — подуровне — три, на d — подуровне — пять, на f — подуровне — 7 орбиталей.
Спиновое квантовое число ( s ) характеризует магнитный момент, возникающий при вращении электрона вокруг своей оси. Принимает только два значения +1/2 и –1/2 соответствующие противоположным направлениям вращения.
Оглавление:
Принципы заполнения орбиталей
1. Принцип Паули. В атоме не может быть двух электронов, у которых значения всех квантовых чисел ( n , l , m , s ) были бы одинаковы, т.е. на каждой орбитали может находиться не более двух электронов ( c противоположными спинами).
2. Правило Клечковского (принцип наименьшей энергии). В основном состоянии каждый электрон располагается так, чтобы его энергия была минимальной. Чем меньше сумма ( n + l ), тем меньше энергия орбитали. При заданном значении ( n + l ) наименьшую энергию имеет орбиталь с меньшим n . Энергия орбиталей возрастает в ряду:
1S 2 электронов, расположенных на n 2 подуровнях.
Полная электронная формула элемента
Цезий ( С s ) находится в 6 периоде, его 55 электронов (порядковый номер 55) распределены по 6 энергетическим уровням и их подуровням. C облюдая последовательность заполнения электронами орбиталей получим:
55 Cs 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 4p 6 4d 10 5s 2 5p 6 5d 10 6s 1
school-sector.relarn.ru
Заполнение электронных орбиталей атомов элементов | Правила Клечковского
Задача 175.
Сколько значений магнитного квантового числа возможно для электронов энергетического подуровня, орбитальное квантовое число которого l = 2? l = 3?
Решение:
Атомные орбитали, которым отвечает значение орбитального квантового числа l, равное 2, называются d-орбиталями. На d-орбитали (d-подуровне) находится пять АО. Графическая схема d-подуровня имеет вид:
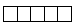
mi — магнитное квантовое число определяет направление электронного облака в пространстве, и принимает значения 0 и целых чисел -1, -2, -3, +1, +2, +3. Так как на d-подуровне содержится пять АО, то, соответственно будет иметь пять разных целочисленных значений, а именно: -2, -1, 0, +1, +2.
Для электронов энергетического подуровня, орбитальное квантовое число которого l = 3, соответствует f-подуровень, содержащий семь АО: . Следовательно, электронам, расположенным на f-подуровне, соответствуют семь значений: -3, -2, -1, 0, +1, +2, +3.
Ответ: 5; 7.
Задача 176.
Какое максимальное число электронов может содержать атом в электронном слое с главным квантовым числом n = 4?
Решение:
В электронном слое с главным квантовым числом n = 4 содержится четыре энергетических подуровня: s-, p-, d- и f-подуровни. Графически это можно представить в виде схемы:
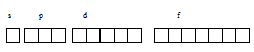
Из схемы вытекает, что в электронном слое с главным квантовым числом n = 4 содержит-ся 16 АО: одна s, три — p, пять — d и семь f. В каждой АО может содержаться по два электрона с противоположными спинами. Таким образом, на четвёртом энергетическом уровне может содержаться 32 электрона (2 . 16 = 32).
Для математического расчёта максимального количества содержания электронов в слое существует простая формула N = 2n2 ,где n — главное квантовое число.
Тогда максимальное число электронов в четвёртом слое равно:
N = 2 . 42 = 32
Ответ: 32.
Задача 177.
Определить по правилу Клечковского последовательность заполнение электронных орбиталей, характеризующихся суммой n + l: а) 5; б) 6; в) 7.
Решение:
Согласно правилам Клечковского, АО заполняются электронами в порядке последовательного увеличения суммы n + l (первое правило Клечковского), и при одинаковых значениях этой суммы – в порядке последовательного возрастания главного квантового числа (2-е правило Клечковского).
а) По условию задачи сумма n + l = 5, причём из всех возможных комбинаций n + l, соответствующих этой сумме ( n = 3, l = 2; n = 4, l = 1; n = 5, l = 0), первой будет реализоваться комбинация с наименьшим значением главного квантового числа, т.е. 3d, затем – 4p, а после 4p – 5s.
Таким образом, при сумме n + l =5 порядок заполнения орбиталей будет следующий: 3d?4p?5s.
б) При сумме n + l = 6 из всех возможных комбинаций n + l, соответствующих этой сумме (n + 4, l = 2; n = 5, l = 1; n = 6, l = 0), первой будет реализоваться комбинация с наи-меньшим значением главного квантового числа, т. е. 4d, затем – 5p, а после 5p – 6s.
Таким образом, при сумме n + l = 6 порядок заполнения орбиталей будет следующий: 4d?5p?6s.
в) При сумме n + l = 7 возможны комбинации n + l, соответствующих этой сумме (n + 4, l = 3; n = 5, l = 2; n = 6, l = 1; n = 7, l = 0), первой будет реализоваться комбинация с наименьшим значением главного квантового числа, т.е. 4f, затем – 5d, далее 6p и уже потом только — 7s.
Таким образом, при сумме n + l = 7 порядок заполнения орбиталей будет следующий: 4f?5d?6p?7s.
Ответ: а) 3d→4p→5s; б) 4d→5p→6s; в) 4f→5d→6p→7s.
Задача 178.
Указать порядковый номер элемента, у которого: а) заканчивается заполнение электронами орбиталей 4d; б) начинается заполнение подуровня 4р.
Решение:
а) 4d-подуровень начинает заполняться после 5s-подуровня. 5s-подуровень начинает заполняться после заполнения электронами 4p-подуровня, т.е. после заполнения оболочки криптона – элемента №36.
Согласно правилу Клечковского после криптона будет заполняться 5s-подуровень, после него – 4d-подуровень. На 5s-подуровне, состоящем из одной атомной орбитали, может находиться два электрона, а на 4d-подуровне, состоящем из пяти атомных орбиталей, может находиться десять электронов. Значит, порядковый номер элемента, с полностью заполненным 4d-подуровнем должен быть на двенадцать больше, чем у криптона (№ 36), значит, элемент № 48 (кадмий). Но, учитывая «провалы» электронов у рутения, родия и палладия с 5s-подуровня на 4d-подуровень (у рутения и родия по одному электрону, а у палладия – два), то 4d-подуровень полностью заполняется электронами у палладия (элемент № 46). Но у элемента № 47 окончательно заканчивается заполнение 4d-орбитали, и 47-й электрон занимает 5s-орбиталь. Таким образом, элемент с порядковым номером 47 считается элементом, у которого заканчивается заполнение электронами 4d-орбитали. Отсюда вывод – порядковый номер элемента 47 (серебро Ag).
б) Согласно правилу Клечковского заполнение электронами 4p-подуровня начинается после заполнения всех атомных орбиталей 3d-подуровня. Элементом, у которого заканчивается заполнение электронами 3d-подуровня является элемент № 30 (цинк). Значит, элементом, у которого начнётся заполнение электронами 4p-подуровня, будет элемент № 31 (галлий Ga).
Ответ: а) Ag; б) Ga.
Задача 179.
Какой подуровень заполняется в атомах после подуровня 5s?
Решение:
Подуровню 5s соответствует сумма n + l, равная 5 (5 + 0 = 5). Такой же суммой n +l характеризуется 4p-подуровень, но заполнению этого подуровня предшествует заполнению 5s-подуровня, так как последнему отвечает большее значение главного квантового числа (второе правило Клечковского). Следовательно, после заполнения 5s-подуровня будет заполняться подуровень с суммой n + l = 6, причём из всех возможных комбинаций n + l, соответствующих этой сумме (n + 4, l = 2; n = 5, l = 1; n = 6, l = 0), первой будет реализоваться комбинация с наименьшим значением главного квантового числа, т.е. вслед за 5s-подуровнем будет заполняться 4d-подуровень n + l = 6.
Ответ: 4d.
Задача 180.
У какого элемента начинает заполняться подуровень 4f? У какого элемента завершается заполнение этого подуровня?
Решение:
Согласно правилам Клечковского 4f-подуровень (n = 4, l = 3) с суммой n + l, равной 7, и с наименьшим значением главного квантового числа, должен заполняться после заполнения 6s-подуровня с суммой n + l, равной 6. Электронную конфигурацию последнего энергетического уровня 6s2 имеет атом элемента № 55 (барий). Затем, у элемента № 57 (лантан), должен начать заполняться 4f-подуровень, но, на самом деле у лантана, расположенного непосредственно после бария появляется не 4f-, а 5d-электрон. Однако уже у следующего за лантаном церия (Z = 58) действительно начинается застройка 4f-подуровня, на который переходит и единственный 5d-электрон, имевшийся в атоме лантана, в соответствии с этим электронная структура атома церия выражается формулой [Kr]4f26s2. Начиная с церия, происходит последовательное заполнение всех орбиталей 4f-подуровня. Далее, начатое заполнение 4f-подуровня у атома церия заканчивается у иттербия (Z = 70).
Ответ: Ce; Yb.
Задача 181.
Какой подуровень заполняется в атомах после заполнения подуровня 5р? После заполнения подуровня 5d?
Решение:
а) Подуровню 5p соответствует сумма n + l =6 (5 + 1 = 6). Такой же суммой n + l характеризуются подуровни 4d и 6s. Заполнение 4d-подуровня, согласно 2-му правилу Клечковского, предшествует заполнению подуровня 5p. После заполнения электронами подуровня 5p, согласно 2-му правилу Клечковского, начнёт заполняться 6s-подуровень, которому отвечает большее значение главного квантового числа n (n = 6).
б) Подуровню 5d соответствует сумма n + l = 7 (5 + 2 = 7). Такой же суммой n + l характеризуется подуровень 4f, но заполнение этого подуровня предшествует заполнению подуровня 5d, так как последнему отвечает большее значение главного квантового числа. Следовательно, согласно 1-го правила Клечковского, будет заполняться подуровень, которому отвечает на единицу большее значение n + l (n = 6) при сумме n + l = 7. Этому условию отвечает подуровень 6p (n = 6, l = 1) при сумме n + l = 7.
Ответ: 6s; 6p.
Задача 182.
Записать электронные формулы атомов элементов с зарядом ядра: а) 8; б) 13; в) 18; г) 23; д) 53; е) 63; ж) 83. Составить графические схемы заполнения электронами валентных орбиталей этих атомов.
Решение:
Электронные формулы отображают распределение электронов в атоме по энергетическим уровням, подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlx, где n — главное квантовое число, l — орбитальное квантовое число (вместо него указывают соответствующие буквенные обозначения – s, p, d, f), x – число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией – меньшая сумма n + l (1-е правило Клечковского), а при одинаковых значениях суммы n + l — в порядке последовательного возрастания главного квантового числа (2-е правило Клечковского). Последовательность заполнения энергетических уровней следующая:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s →
→ (5d1) → 4f → 5d → 6p → 7s → (6d1-2) → 5f → 6d → 7p.
Так как число электронов в атоме элемента численно равно его порядковому номеру в таблице Д.И. Менделеева, то электронные формулы элементов №№ 8, 13, 18, 23, 53, 63, 83 будут иметь вид:
а) +8О 1s 2 2s 2 2p 4 ;
б) +13Al 1s 2 2s 2 2p 6 3s 2 3p 1 ;
в) +18Ar 1s 2 2s 2 2p 6 3s 2 3p 6 ;
г) +23V 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 4s 2 ;
д) +53I 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 5s 2 5p 5 ;
е) +63Eu 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 7 5s 2 5p 6 6s 2 ;
ж) +83Bi 1s 2 2s 2 2p 6 3s 2 3p63d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 6s 2 6p 3 .
Графические схемы заполнения валентных орбиталей атомов элементов:
Электронная структура атома может быть изображена также в виде схем размещения электронов в квантовых (энергетических) ячейках, которые являются схематическим изображением атомных орбиталей (АО). Квантовую ячейку обозначают в виде прямоугольника  , кружочка
, кружочка  или линейки
или линейки  , а электроны в этих ячейках обозначают стрелками
, а электроны в этих ячейках обозначают стрелками  . В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами, например
. В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами, например 
Мы будем применять линейки. Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда):
buzani.ru
Порядок заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах;
Последовательность заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах определяют:
1. принцип наименьшей энергии;
2. правило Клечковского;
3. принцип запрета Паули;
4. правило Гунда.
Принцип наименьшей энергии:максимуму устойчивости системы соответствует минимум её энергии.
Следовательно, в соответствии с данным принципом электроны будут вначале располагаться на атомных орбиталях, имеющих минимальную энергию, в этом случае связь электронов с ядром наиболее прочная и атомная система находится в состоянии максимальной устойчивости.
В  многоэлектронных атомах электроны испытывают не только притяжение ядер, но и отталкивание электронов, находящихся ближе к ядру и экранирующих ядро от более далеко расположенных электронов. Поэтому последовательность возрастания энергии орбиталей усложняется.
многоэлектронных атомах электроны испытывают не только притяжение ядер, но и отталкивание электронов, находящихся ближе к ядру и экранирующих ядро от более далеко расположенных электронов. Поэтому последовательность возрастания энергии орбиталей усложняется.
Порядок возрастания энергии атомных орбиталей в сложных атомах описывается правилом Клечковского: при увеличении заряда ядра атома заполнение орбиталей происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n+l), а при равных значениях суммы (n+l) – в порядке возрастания n.
Соответственно этому правилу подуровни выстраиваются в следующий ряд (рис. 2.4.): 1s 2 , емкость энергетического уровня составляет 2n 2 электронов, где n – соответствующее значение главного квантового числа.
Правило Гунда:устойчивому (невозбужденному) состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спинового числа их (│∑ms│) максимально.
Другими словами: заполнение орбиталей одного подуровня в основном состоянии атома начинается одиночными электронами с одинаковыми спинами. После того как одиночные электроны займут все орбитали в данном подуровне, заполняются орбитали вторыми электронами с противоположными спинами.
1.8. Электронные семейства элементов
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делятся на четыре типа – электронные семейства:
1. s – элементы; заполняется электронами s – подуровень внешнего уровня. К ним относятся первые два элемента каждого периода. Валентными 1 являются электроны внешнего уровня.
2. p – элементы; заполняется электронами р – подуровень внешнего уровня. Это последние шесть элементов каждого периода (кроме I и VII). Валентными являются s- и p- электроны внешнего уровня.
3. d – элементы; заполняется электронами d – подуровень второго снаружи уровня, а на внешнем уровне – один или два электрона (y 46Pd – нуль). К ним относятся элементы вставных декад больших периодов, расположенных между s – и p – элементами (их также называют переходными элементами). Валентными являются s – электроны внешнего уровня и d – электроны предвнешнего уровня (второго снаружи).
4. f – элементы; заполняется электронами f – подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Они расположены в 6 – м (4f – элементы) и 7 – м (5f – элементы) периодах периодической системы. 4f – элементы объединяют в семейство лантаноидов, а 5f – элементы – семейство актиноидов.
В периодической системе s – элементов 14, p – элементов 30, d – элементов 38, f – элементов 28.
studopedia.su
Правила заполнения электронных орбиталей в атомах


2.3. Заполнения атомных орбиталей
Заселение электронами атомных орбиталей (АО) осуществляется согласно принципу наименьшей энергии, принципу Паули и правилу Гунда.

Принцип наименьшей энергии требует, чтобы электроны заселяли АО в порядке увеличения энергии элекронов на этих орбиталях. Это отражает общее правило – максимуму устойчивости системы соответствует минимум ее энергии.
Принцип Паули запрещает в многоэлектронном атоме находиться электронам с одинаковым набором квантовых чисел. Это означает, что два любых электрона в атоме (или молекуле, или ионе) должны отличаться друг от друга значением хотя бы одного квантового числа, то есть на одной орбитали может быть не более двух электронов с различными спинами (спаренных электронов). Каждый подуровень содержит 2 l + 1 орбитали, на которых размещаются не более 2(2 l + 1) электронов. Отсюда следует, что емкость s -орбиталей – 2, p -орбиталей – 6, d -орбиталей – 10 и f -орбиталей – 14 электронов. Если число электронов при заданном l просуммировать от 0 до n – 1, то получим формулу Бора–Бьюри, определяющую общее число электронов на уровне с заданным n :

Эта формула не учитывает межэлектронное взаимодействие и перестает выполняться при n ≥ 3.
Орбитали с одинаковыми энергиями (вырожденные) заполняются в соответствии с правилом Гунда : наименьшей энергией обладает электронная конфигурация с максимальным спином. Это означает, что если на p-орбитали три электрона, то они располагаются так: 

 , и суммарный спин S = 3/2 , а не так:
, и суммарный спин S = 3/2 , а не так: 

 , S = 1/2 .
, S = 1/2 .
chemistry.ru

